班级 姓名 高一化学必修2![]()
第一章 物质结构 元素周期律
第一节 元素周期表
课时1 元素周期表
【知识清单】
1.元素周期表(The Periodic Table)
化学元素周期表是根据原子序数从小至大排序的化学元素列表。列表大体呈长方形,某些元素周期中留有空格,使特性相近的元素归在同一族中,如卤素、碱金属元素、稀有气体(又称惰性气体或贵族气体)等。这使周期表中形成元素分区且分有七主族、七副族与零族、第Ⅷ族。由于周期表能够准确地预测各种元素的特性及其之间的关系,因此它在化学及其他科学范畴中被广泛使用,作为分析化学行为时十分有用的框架。
俄国化学家门捷列夫(Dmitri Mendeleev)于1869年发明周期表,这张表揭示了物质世界的秘密,把一些看来似乎互不相关的元素统一起来,组成了一个完整的自然体系。它的发明,是近代化学史上的一个创举,对于促进化学的发展,起了巨大的作用。
2.在下表中画出1~18号元素的原子结构示意图:
|
|
| |||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
【知识建构】
一、原子序数与元素的原子结构关系
原子序数= = =
二、元素周期表的编排原则
1.横行
相同的元素,按 递增的顺序从左到右排成横行。
2.纵行
相同的元素,按 递增的顺序由上而下排成纵行。
三、元素周期表的结构
1.周期:元素周期表有 个横行,每一横行称为一个周期,元素周期表共有 个周期。
类别 | 周期 序数 | 起止 元素 | 包括元 素种数 | 核外电 子层数 | 稀有气体 原子序数 | 位置与结 构的关系 |
短 周 期 | 1 | ~ |
|
|
| 周期序数 = |
2 | ~ |
|
|
| ||
3 | ~ |
|
|
| ||
长 周 期 | 4 | ~ |
|
|
| |
5 | ~ |
|
|
| ||
6 | ~ |
|
|
| ||
7 | Fr~118号 |
|
|
|
2.族
现在常用的元素周期表有 个纵行,它们被划分为 个族,包括 个主族, 个副族, 个第Ⅷ族(其中第 这3个纵行称为第Ⅷ族), 个0族。
主族序数=
周期表中有些族有特别的名称。例如:
第IA族: 第VIIA族: 0族: 。
【典型例题】
例题1.下列说法正确的是( )
A.我们常用的元素周期表中元素排序的依据是元素的相对原子质量
B.元素周期表中同一横行元素原子的电子层数相同
C.元素周期表有16个纵行
D.元素周期表已发展成一个稳定的形式,它不可能再有新的变化了
例题2.已知元素的原子序数,不可以推断元素原子的( )
A.质子数 B.核电荷数 C.核外电子数 D.离子所带的电荷数
例题3.已知碳元素、镁元素和溴元素的原子结构示意图,它们分别位于元素周期表的什么位置?说明判断理由。
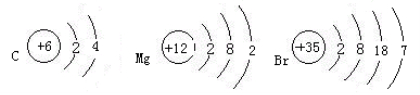
C: Mg: Br:
例题4.已知某元素位于元素周期表中第三周期,第ⅣA族,画出其原子结构示意图,并在周期表中找出其为何种元素。
例题5.已知元素周期表中各周期可排元素种数如下表所示:
周期数 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
元素数 | 2 | 8 | 8 | 18 | 18 | 32 | - |
(1)第6、7周期比第4、5周期多了14种元素,其原因是 。
(2)周期表中________族所含元素最多。
(3)请分析周期数与元素种数的关系,预言第8周期最多可能含有的元素种数为( )
A.18 B.32 C.50 D.64
【课后习题】
1.( )1869年,俄国化学家门捷列夫制作出了第一张元素周期表,提示了化学元素间的内在联系,成为化学史上重要里程碑之一。下列有关元素周期表的说法正确的是
A.元素周期表有七个周期 B.元素周期表有18个族
C.IA族的元素全部是金属元素 D.短周期是指第一、二、三、四周期
2.( )下列说法中正确的是
A.最外层电子数相同的元素都在同一族
B.同族元素的最外层电子数一定相同
C.同周期元素的电子层数都相同
D.周期表是按相对原子质量逐渐增大的顺序从左到右排列的
3.( )某一周期ⅡA族元素的原子序数为x,则同周期的ⅢA族元素的原子序数不可能是
A.x+1 B.x+8 C.x+11 D.x+25
4.( )有三种短周期元素,最外层电子数之和为17,质子数之和为31。如果这三种元素中有一种是氩元素,则关于另外两种元素的说法不正确的是
A.两元素必在同一周期 B.两元素可能在相邻两周期
C.两元素不可能同为金属元素 D.两元素不可能同主族
5.第三周期第IVA族的元素原子序数是 ;Na元素的原子序数为11,相邻的同族元素的原子序数是 ;短周期元素中,主族序数=周期序数的元素有 ;(填元素符号,下同)主族序数等于周期序数2倍的元素有 ;周期序数=主族序数2倍的有 。
6.A元素原子M电子层上有6个电子,B元素与A元素的原子核外电子层数相同,B元素的原子最外层电子数为1。
(1)B元素的原子结构示意图为 ;
(2)A元素在周期表中的位置 ,B元素在周期表中的位置 ;
(3)A、B两元素形成的化合物名称为 ,该物质在火焰上灼烧时火焰呈 。
*7.某元素R的原子核外电子数等于核内中子数。取该元素单质2.8 g与足量O2化合,可得6 g氧化物RO2,则该元素在周期表中的位置是 。
第一章 物质结构 元素周期律
第一节 元素周期表
课时2 碱金属
【知识清单】
【知识建构】
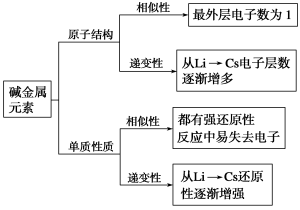
1.碱金属元素
(1)碱金属元素原子结构
元素 名称 | 元素 符号 | 核电 荷数 | 原子结构 示意图 | 最外层 电子数 | 电子 层数 | 原子半 径/nm |
锂 |
|
|
|
|
| 0.152 |
钠 |
|
|
|
|
| 0.186 |
钾 |
|
|
|
|
| 0.227 |
铷 |
|
|
|
|
| 0.248 |
铯 |
|
|
|
|
| 0.265 |
小结:① 相同点:碱金属元素原子结构中 相同, 都为 。
② 递变性:从Li到Cs,碱金属元素的原子结构中, 依次增多。
(2)碱金属物理性质
|
| Li Na K Rb Cs |
相似性 | 颜色 |
|
硬度 |
| |
密度 |
| |
熔沸点 |
| |
导电导热性 |
| |
递变性 | 密度 |
|
熔沸点 |
|
(3)碱金属化学性质
①相似性:碱金属元素均易 电子,体现强 。
②递变性:碱金属元素从上到下(Li 、Na、K、Rb、Cs),随着核电荷数的增加,原子核对 的吸引力逐渐减弱,原子失电子的能力逐渐 。元素的金属性逐渐 ,与水和氧气的反应越来越 ,生成的氧化物越来越 ;最高价氧化物对应水化物的碱性越来越 。
【典型例题】
例题1.关于碱金属单质的性质叙述错误的是( )
A.在空气中燃烧的生成物都是过氧化物 B.与盐溶液反应时都能生成碱和氢气
C.熔沸点随原子序数增加而升高 D.还原性随原子电子层数的增加而增加
例题2.锂(Li)是世界上最轻的金属,它属于碱金属的一种,下列说法正确的是( )
A.和Li同一主族的都是金属元素
B.Na+比Li多一个电子层
C.Li、Na、K+的最外层都只有一个电子
D.Li是碱金属中原子半径最小的原子
【课后习题】
1.( )关于钠和钾元素的比较中,不正确的是
A.钾原子失电子比钠原子容易
B.钾离子氧化性比钠离子强
C.钾与水反应比钠剧烈
D.KOH碱性比NaOH强
2.( )下列关于碱金属的叙述中正确的是
A.碱金属单质与水反应都能生成碱和H2
B.碱金属单质都是质软、熔点低、密度均小于1的轻金属
C.碱金属元素随原子半径增大,原子核吸引最外层电子的能力增强
D.碱金属单质在空气中燃烧都生成过氧化物\
3.( )下列说法正确的是
A.碱性:LiOH>NaOH>KOH>RbOH
B.金属性:Rb>K>Na>Li
C.和酸反应时Fe能失2e-,Na失1e-,所以Fe的金属性强于Na
D.Rb不易与水反应放出H2
4.( )金属元素钫(Fr)在自然界中含量极少。它的21个已知同位素都有放射性。它是碱金属元素中最重的元素。根据它在周期表中的位置预言其性质,其中不正确的是
A.在已知碱金属元素中具有最大的原子半径
B.在空气中燃烧时生成氧化物Fr2O
C.氧化物对应的水化物是极强的碱
D.其单质的熔点比金属钠的熔点低
5.有A、B、C、D四种短周期元素, 它们的原子序数由A到D依次增大, 已知A和C原子最外层只有一个电子,C燃烧时的焰色反应是黄色,C的单质在高温下与B的单质充分反应可以产生淡黄色固态化合物,A单质与D单质可以发生化合反应,且反应条件可以是点燃或者光照,试根据以上叙述回答:
(1)写出A、B、C、D的元素名称:A _______ B _______ C _______ D ______。
(2)写出化学方程式:
① C+B: ,
② A+D: 。
6.甲元素的原子序数是19,乙元素原子核外有两个电子层,最外电子层上有6个电子;丙是元素周期表第ⅠA族中金属性最弱的碱金属元素。由此推断:
⑴ 甲元素在周期表中位于第________周期;乙元素在周期表中位于第______族;丙元素的名称为________。
⑵ 甲的单质与水反应的离子方程式为______________________________________;
⑶ 乙单质与丙单质反应的化学方程式为_____________________________________
7.主族元素A、B、C、D都是短周期元素,A、D同主族,B、C在同一周期,A、D原子的最外层电子数都是1,C原子最外层电子数比B原子少2个,且最外层电子数是次外层电子数的2倍。A、B单质在常温下均为气体。它们在一定条件下以体积比2∶1完全反应,生成物在常温下是液体。此液体与D单质能剧烈反应生成A的单质。所得溶液中含有与氖原子的电子层结构相同的阳离子。
回答下列问题:
(1)写出元素符号A__ _,B__ _,C__ _,D__ _。
(2)写出B单质与D在加热反应后生成物质的化学式__ _。
(3)写出一种有A、B、C、D组成的化合物的化学式__ _。
第一章 物质结构 元素周期律
第一节 元素周期表
课时3 卤族元素
【知识清单】
卤族元素(halogen)
由于卤素可以和很多金属形成盐类,因此英文卤素(halogen)来源于希腊语halos(盐)和gennan(形成)两个词。在中文里,卤的原意是盐碱地的意思。
卤族元素指周期系ⅦA族元素。包括氟(F)、氯(Cl)、溴(Br)、碘(I)、砹(At),简称卤素。它们在自然界都以典型的盐类存在 ,是成盐元素。卤族元素的单质都是双原子分子,它们的物理性质的改变都是很有规律的,随着分子量的增大,卤素分子间的色散力逐渐增强,颜色变深,它们的熔点、沸点、密度、原子体积也依次递增(石田的熔点及沸点未知)。卤素都有氧化性,氟单质的氧化性最强。卤族元素和金属元素构成大量无机盐,此外,在有机合成等领域也发挥着重要的作用。
【知识建构】
1. 卤素原子的结构
元素名称 | 氟(F) | 氯(Cl) | 溴(Br) | 碘(I) |
原子序数 |
|
|
|
|
原子结构示意图 |
|
|
|
|
最外层电子数 |
|
|
|
|
电子层数 |
|
|
|
|
原子半径 | 随电子层数增多,半径 | |||
[小结]
(1)卤族元素的原子最外层电子数相同,都易 一个电子,具有较强的 。
(2)随着原子序数的递增,原子核外电子层数依次 ,原子半径逐渐 。
2. 卤素单质的物理性质
单质 | F2 Cl2 Br2 I2 | |
相似性 | 都有颜色 | |
都不易溶于 ,易溶于 等有机溶剂(F2易和水发生反应) | ||
递变 性 | 状态(通常状况下) | 气体→气体→液体→固体 |
颜色 | 色→ 色→ 色→ 色(逐渐 ) | |
密度 | 逐渐 | |
熔点和沸点 | 逐渐 | |
在水中的溶解度 | 逐渐 | |
3. 卤素单质的化学性质
(1)与氢气反应
| 反应条件 | 化学方程式 | 产物稳定性 |
F2 |
|
|
|
Cl2 |
|
|
|
Br2 |
|
|
|
I2 |
|
|
|
[小结]分析上表可知,从F2到I2,与H2反应所需要的条件逐渐 ,反应剧烈程度依次 ,生成 .气态氢化物的稳定性依次 。
(2)置换反应
实验操作 | 实验现象 | 化学方程式 |
| 静置后,液体分层,上层 色,下层 色 |
|
| 静置后,液体分层,上层 色,下层 色 |
|
| 静置后,液体分层,上层 色,下层 色 |
|
[小结]由以上实验可知, Cl2、Br2、I2的氧化性逐渐 。
【典型例题】
例题1.砹是原子序数最大的卤族元素,根据卤素性质的递变规律,下列说法正确的是( )
A.与H2化合能力:At2>I2 B.砹在常温下为白色固体
C.砹原子的最外电子层上有7个电子 D.砹能从NaCl溶液中置换出氯单质
例题2.①溴水 ②氯水 ③碘酒 ④氯化钾 ⑤酸性高锰酸钾溶液。其中能使湿润的淀粉­KI 试纸变蓝的是( )
A.①②③ B.①⑤ C.①②③⑤ D.③④⑤
【课后习题】
1.( )随着卤素原子半径的增大,下列递变规律正确的是
A.单质的熔、沸点逐渐降低 B.卤素离子的还原性逐渐增强
C.单质的氧性逐渐增强 D.气态氢化物的稳定性逐渐增强
2.( )砹(At)是卤族元素中位于碘后的元素,推测砹和砹的化合物最不可能具备的性质是
A.砹易溶于某些有机溶剂 B.砹化氢很稳定不易分解
C.砹是有色固体 D.砹化银不溶于水或稀硝酸
3.( )甲、乙、丙三种溶液各含有一种X-(X-为Cl-、Br-、I-),向甲中加淀粉溶液和新制的氯水,则溶液变为橙色,再加丙溶液,颜色无明显变化。则甲、乙、丙依次含有
A.Br-、Cl-、I- B.Br-、I-、Cl-
C.I-、Br-、Cl- D.Cl-、I-、Br-
4.( )往碘化钾溶液中先加入氯水,再加入CCl4振荡,静置后出现分层,下层呈
A.橙红色 B.紫红色 C.无色 D.深褐色
5.( )下面的叙述正确的是
A.使湿润淀粉­KI试纸变蓝色的气体必为氯气
B.氟气与熔融状态下氯化钠反应可产生氯气
C.易见光分解的AgNO3晶体,应存放于棕色细口试剂瓶中
D.溴水应存放在胶头滴瓶(棕色)中
*6.( )溴化碘(IBr)的化学性质很像卤素的单质,它能与大多数金属、非金属化合生成卤化物,它也能与水发生以下反应:IBr+H2O===HBr+HIO,下列有关IBr的叙述中,不正确的是
A.在很多反应中IBr是强氧化剂
B.IBr与水反应时既作氧化剂,又作还原剂
C.IBr与AgNO3溶液反应会生成AgBr沉淀
D.IBr与NaOH溶液反应时,生成NaBr和NaIO
7.写出下列反应的离子方程式
(1)溴与碘化钾反应:
(2)钾与水反应:
8.下表为元素周期表的一部分。
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
一 | ① |
| |||||
二 | ② |
|
| ③ | ④ | ⑤ | ⑥ |
三 | ⑦ | ⑧ |
|
|
| ⑨ | ⑩ |
⑴ 表中元素______的非金属性最强;元素________的金属性最强(填写元素符号);
⑵ 表中元素⑥⑩氢化物的稳定性顺序为____________>____________ (填写化学式)。
1
第一章 元素周期表
班级 姓名 高一化学必修2![]()
第一章 物质结构 元素周期律
第一节 元素周期表
课时4 核素
【知识清单】
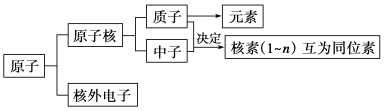
1. 原子结构
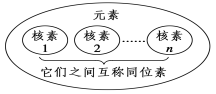
2.元素、核素、同位素之间的关系
【知识建构】
一、原子结构
![]()
![]() 原子核
原子核
1.原子的构成
核外电子
构成原子的粒子 | 电 子 | 质 子 | 中 子 |
电性和电量 | 1个电子带1个单位负电荷 | 1个质子带1个单位正电荷 | 不显电性 |
质量/kg | 9.109×10-31 | 1.673×10-27 | 1.675×10-27 |
相对质量 | 1/1836(电子与质子质量之比) | 1.007 | 1.008 |
小结:原子的质量主要集中在 ,质子和中子的相对质量都近似为1,如果忽略电子的质量,将核内所有 叫做质量数。
2.质量数(A)
质量数(A)= +
应用:用质量数表示某种原子 ![]()
符号 | 质子数 | 中子数 | 质量数 | 电子数 |
|
|
|
|
|
|
|
|
|
|
| 12 | 12 |
| 12 |
|
| 20 | 40 | 18 |
二、核素
完成下列表格
元素符号 | 原子符号 | 核电荷数 | 中子数 | 电子数 |
|
| 1 | 0 | 1 |
| 1 | 1 | 1 | |
| 1 | 2 | 1 | |
|
| 6 | 6 | 6 |
|
|
|
| |
| 6 | 8 | 6 |
元素:
核素:
同位素:
同位素特点:
(1)同位素在周期表里占据 。
(2)同位素的 性质几乎完全相同, 性质略有差异。
(3)在天然存在的某种元素里,不论是游离态还是化合态,各种同位素的原子个数百分比(丰度)一般为 。
【典型例题】
例题1. 某元素的阳离子![]() ,核外共有x个电子,原子的质量数为A,则该元素原子里中子数为( )
,核外共有x个电子,原子的质量数为A,则该元素原子里中子数为( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
例题2.下列说法正确的是 ( )
A.同一元素各核素的质量数不同,但它们的化学性质几乎完全相同
B.任何元素的原子都是由核外电子和核内中子、质子组成的
C.钠原子失去一个电子后,它的电子数与氖原子相同,所以变成氖原子
D. ![]() 、
、 ![]() 、
、 ![]() 的质量数相同,所以它们是互为同位素
的质量数相同,所以它们是互为同位素
例题3.设某元素的原子核内的质子数为m,中子数为n,则下述论断正确的是( )
A.不能由此确定该元素的相对原子质量
B.这种元素的相对原子质量为![]()
C.若碳原子质量为![]() ,此原子的质量为
,此原子的质量为![]()
D.核内中子的总质量小于质子的总质量
【课后习题】
1.( )下列各组中属于同位素的是
A.40K与40Ca B.T2O和H2O C.40K与39K D.金刚石与石墨
2.( )我国的纳米基础研究能力已跻身于世界前列,例如曾作为我国两年前十大科技成果之一的就是一种合成纳米材料,化学式为RN。已知该化合物中的Rn+核外有28个电子。则R元素位于元素周期表的
A.第3周期ⅤA族 B.第4周期ⅢA族
C.第5周期ⅢA族D.第4周期ⅤA族
*3.( )某元素的天然同位素有![]() X和
X和![]() X两种,如果该元素的相对原子质量为10.8,那么元素X的天然同位素中
X两种,如果该元素的相对原子质量为10.8,那么元素X的天然同位素中![]() X和
X和![]() X的原子个数之比为
X的原子个数之比为
A.3∶1 B. 1∶3 C. 4∶1 D. 1∶4
4.( )已知R2+核内共有N个中子,R的质量数为A,确定m g R2+中含有电子的物质的量为
![]()
![]()
![]()
![]()
![]()
![]() A. mol B. mol C. mol D. mol
A. mol B. mol C. mol D. mol
5.在(1)Li、(2) N、(3) Na、 (4) Mg、(5) Li、(6) C中:
(1) 和 互为同位素。
(2) 和 质量数相等,但不能互称同位素。
(3) 和 的中子数相等,但质子数不相等,所以不是同一种元素。
6.有H、D、T三种原子,它们之间的关系是_________。在标准状况下,它们的单质的密度之比是_________;lmol各种单质中,它们的质子数之比是_________;在标准状况下,1L的各种单质中它们的电子数之比是_________。
7.今有A、B、C、D四种元素,其中A元素是1826年法国青年科学家巴拉尔发现的。他在研究海水制盐时,往剩余的副产物苦卤中通入氯气后发现溶液颜色变深,若经进一步提取,可得一种红棕色液体,有刺鼻的臭味。B、C、D的原子电子层排布均不超过3个电子层。D原子核内的质子数正好等于C原子核内质子数的2倍,而它们最外电子层上的电子数恰好相等。D原子的最内电子层上电子数是B原子核外电子数的2倍。则:
(1)四种元素分别是为:A________,B________,C________,D________。
(2)写出巴拉尔发现A元素单质的离子方程式:
________________________________________________________________________。
(3)写出由上述某元素的单质与另外两种元素的化合物反应生成两种酸的化学方程式
________________________________________________________________________。
1
第一章 元素周期表
班级 姓名 高一化学必修2![]()
第一章 物质结构 元素周期律
第二节 元素周期律
课时1 原子核外电子的排布
【知识清单】
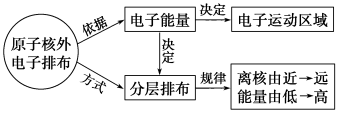
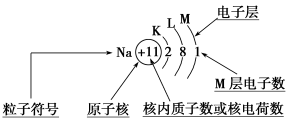
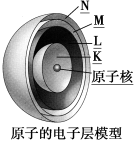 【知识建构】
【知识建构】
一、 原子核外电子排布
观察电子层模型示意图,填写下表:
电子层序号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
电子层符号 |
|
|
|
|
|
|
|
离核距离 |
电子离核由 到 | ||||||
能量高低 | 由 到 | ||||||
小结:原子核外电子排布规律
(1)能量高的电子在离核较 的区域运动,能量低的电子在离核较 的区域运动。
(2)
电子层序号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
最多容纳电子数 |
|
|
|
|
|
|
|
(3)最外层最多能容纳的电子数目为 (K层为最外层,不超过 个电子),次外层电子数目不超过 ,倒数第三层不超过 个电子。
【典型例题】
例题1.根据条件填写元素符号。
(1)某元素有3个电子层,最外层电子数是电子总数的1/6,该元素是______。
(2)A原子L层上的电子数等于次外层上的电子数也等于电子层数,A是 。
(3)B原子核外M层电子数是L层电子数的1/2,则B是 。
(4)C原子的次外层电子数是最外层电子数的1/4。则C是 。
例题2.判断下列示意图是否正确?为什么?
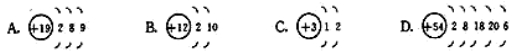
例题3.根据下列叙述,写出元素名称并画出原子结构示意图。
信息 | 元素名称 | 原子结构示意图 |
元素M原子核外M层电子数是L层电子数的一半 |
|
|
元素T原子最外层电子数是次外层电子数的1.5倍 |
|
|
元素Q的+1价离子C+的电子层排布与Ne相同 |
|
|
元素Z原子次外层电子数是最外层电子数的 |
|
|
【课后习题】
1.( )A元素原子核外电子数比B元素原子核外电子数少5个,且A元素原子L层比B元素原子L层少3个电子,则A,B两元素形成的化合物可表示为
A.A3B2 B.A2B3 C.AB3 D.AB2
2.( )有aXn-和bYm+ 2种离子,其电子结构相同,则
A.a-n=b+m B.a+m=b-n
C.氧化物为YOm D.氢化物为HnX或XHn
3.( )1~18号元素的离子中,原子核电荷数和离子最外层电子数相同的是
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
4.( )元素X的原子核外M电子层上有3个电子,元素![]() 的离子核外有18个电子,则这两种元素可形成的化合物为
的离子核外有18个电子,则这两种元素可形成的化合物为
A.XY2 B.X2Y3 C.X3Y2 D.X2Y
5.( )在下列各组元素中,按核电荷数递增而粒子半径递减的一组是
A.F、Cl、Br B.P、S、Cl C.Na、Al、F D.Na+、K+、Rb+
6.( )下列有关叙述中正确的是
A.元素的性质随着相对原子质量的递增而呈周期性变化
B.两种粒子如果核外电子排布相同,一定是同一种元素
C.原子的次外层电子数不一定是8个
D.一切原子的原子核都是由质子和中子构成的
*7.元素A的原子核内质子数和中子数相等,它形成的气态氢化物在标准状况下密度为0.771g·L—1,此氢化物的化学式为AH3,则此元素的符号是 ,原子结构示意图
为 ,最高价氧化物对应的水化物化学式为 。
8.A、B、C三种元素的原子具有相同的电子层数,而B的核电荷数比A大2,C原子的电子总数比B原子电子总数多4。1molA的单质跟足量的HCl反应可置换出11.2L(标准状况下)的氢气,这时A转变成与氖原子具有相同电子层结构的离子。
试回答:
(1)A是 元素,B是 元素,C是 元素。
(2)分别写出A、B最高正价氧化物对应水化物跟C的气态氢化物的水溶液反应的离子方程式 , 。
9.已知A、B、C三种元素的原子中,质子数为A<B<C,且都小于18,A元素的原子最外层电子数是次外层电子数的2倍;B元素的原子核外M层电子数是L层电子数的一半;C元素的原子次外层电子数比最外层电子数多1个。试推断:
(1)三种元素的名称和符号:A ,B ,C 。
(2)画出三种元素的原子结构示意图:A ,B ,
C 。
第一章 物质结构 元素周期律
第二节 元素周期律
课时2 元素周期律
【知识清单】
1.元素原子核外电子排布的周期性变化
规律:随着原子序数的递增,元素原子的最外层电子排布呈现由1到8的周期性变化(第一周期除外)。
2.元素原子半径的周期性变化
规律:随着原子序数的递增,元素的原子半径呈现由大到小的周期性变化。
3.元素主要化合价的周期性变化
规律:随着原子序数的递增,元素的最高正化合价呈现+1→+7,最低负化合价呈现-4→-1的周期性变化。
【知识建构】
二、元素周期律
(1)原子的核外电子排布的周期性:
原子序数 | 电子层数 | 最外层电子数 | 达到稳定结构时的最外层电子数 |
1~2 | 1 | |
|
3~10 | 2 | |
|
11~18 | 3 | |
|
结论:随着原子序数的递增,最外层电子数由 递增至 (若K层为最外层则由1递增至 ),元素原子的最外层电子排布呈现周期性变化。 | |||
(2)原子半径的递变规律:
原子序数 | 原子半径的变化 |
3~9 | 逐渐 |
11~17 | 逐渐 |
结论:同一周期,随着原子序数的递增,元素原子半径逐渐 ,呈现 变化。 | |
原子序数 | 原子半径的变化 |
1、3、11 | 逐渐 |
4、12 | 逐渐 |
结论:同一主族,随着原子序数的递增,元素原子半径逐渐 。 | |
(3)化合价的周期性变化:
原子序数 | 化合价的变化 |
1~2 |
|
3~9 | 最高正价: 最低负价: |
11~17 | 最高正价: 最低负价: |
结论:随着原子序数的递增,最高正价由 递变到 ,从中部开始有负价,从 递变至 (稀有气体元素化合价为零),元素化合价呈现周期性变化。 | |
注意: (1)元素主要化合价由元素原子的 决定。
(2)金属无 价,F无 价。
(3)│最高正价│+│负价│=
【典型例题】
例题1.从原子序数11依次增加到17,下列所述递变关系错误的是 ( )
A.原子电子层数不变 B.原子半径逐渐增大
C.最高正价数值逐渐增大 D.从硅到氯负价呈现从-4→-1
例题2.比较下列微粒的半径大小。
(1)Li Na K Rb Cs;
I Br Cl F;
(2)F O N C;
(3)Na Na+ ; Cl Cl-
(4)I- Br- Cl- F-
Li+ Na+ K+ Rb+ Cs+
(5)O2- F- Na+ Mg2+ Al3+;
S2- Cl- K+ Ca2+。
【课后习题】
1.( )某元素的最高正价与最低负价的代数和为4,则该元素原子的最外层电子为
A.4 B.5 C .6 D.7
2.( )有A、B两种元素,已知元素A的核电荷数为a,且A3-与Bn+的电子排布完全相同,则元素B的核电荷数为
A.a—n一3 B.a +n+3 C.a+n一3 D.a—n+3
3.( )下列各组元素性质的递变情况错误的是
A.Li、Be、B原子最外层电子数依次增多
B.P、S、C1元素最高正价依次升高
C.N、O、F原子半径依次增大
D.Na、K、Rb的电子层数依次增多
4.( )A、B、C为三种短周期元素,A、B在同一周期,A、C的最低价离子分别为A2-、C-,离子半径A2-大于C-,B2+和C-具有相同的电子层结构。下列判断正确的是
A.原子序数由大到小的顺序是C>A>B
B.原子半径由大到小的顺序是r(B)>r(A)>r(C)
C.离子半径由大到小的顺序是r(C-)>r(B2+)>r(A2-)
D.原子最外层电子数由多到少的顺序是B>A>C
![]() 5.( )下列微粒半径大小的比较中,正确的是
5.( )下列微粒半径大小的比较中,正确的是
A.Na+<Mg2+<Al3+<O2-
B.S2->Cl->Na+>Al3+
C.Na<Mg<Al<S
D.Cs<Rb<K<Na
6. A、B、C、D 4种元素的核电荷数依次增大,它们的离子的电子层数相同且最外层电子数均为8。A原子的L层电子数与K、M层电子数之和相等,D原子的K、L层电子数之和等于电子总数的一半。
请回答下列问题:
(1)4种元素的符号依次是A____________,B__________,C____________,D____________。它们的原子半径由大到小的顺序是______________________(用元素符号表示)。
(2)试写出4种元素离子的半径由大到小的顺序____________________________。(用离子符号表示)
(3)A元素的最高正化合价为 。
1
第一章 元素周期表
班级 姓名 高一化学必修2![]()
第一章 物质结构 元素周期律
第二节 元素周期律
课时3 元素周期律
【知识清单】
同周期元素的金属性与非金属性的周期性变化

【知识建构】
二、元素周期律
(4)元素的金属性与非金属性的周期性变化
钠、镁、铝(同周期的金属)的性质比较
| 钠 | 镁 | 铝 |
单质与水(或酸)反应 | 与冷水反应:反应 ,放出氢气。 | 与冷水反应缓慢,与沸水反应快。与酸反应剧烈,都放出氢气。 | 与酸反应 ,放出氢气。 |
最高价氧化物对应水化物碱性强弱 | NaOH ( ) | Mg(OH)2 中强碱 | Al(OH)3 ( ) |
结论:Na Mg Al 金属性逐渐 。 | |||
小结:元素金属性强弱的判断
① 金属单质与水(或酸)反应置换出H2的难易程度(越易置换出氢气,说明金属性 )
② 最高价氧化物的水化物——氢氧化物的碱性强弱(碱性越强,则金属性 )
③ 金属单质之间的置换(金属性 的置换金属性 的)
④ 金属活动性顺序表(位置越靠前,说明金属性 )
⑤ 金属阳离子氧化性的强弱(对应金属阳离子氧化性越弱,金属性 )
阅读课本第16页表格,填写下表。
| Si | P | S | Cl |
单质与氢气反应的条件 |
| |||
气态氢化物的稳定性 |
| |||
最高价氧化物对应水化物的酸性 |
| |||
结论:Si、P、S、Cl 非金属性逐渐 | ||||
小结:元素非金属性强弱的判断
①单质与H2化合的难易程度(与H2化合越容易,说明非金属性 )
②形成的气态氢化物的稳定性(形成的气态氢化物越稳定,则非金属性 )
③最高价氧化物的水化物——最高价含氧酸酸性的强弱(酸性越强,说明非金属性 )
④非金属单质之间的置换(非金属性 的置换非金属性 的)
⑤非金属阴离子还原性的强弱(对应非金属阴离子还原性越弱,非金属性 )
(5)元素周期律:元素的性质随着元素 的递增而呈现 的变化。
元素性质的周期性变化实质:是元素原子的 的周期性变化。
【典型例题】
例题1. 同一横行X、Y、Z三种元素,已知最高价氧化物对应的水化物的酸性是 HXO4 > H2YO4 > H3ZO4,则下列说法判断错误的是 ( )
A. 阴离子半径 X > Y > Z B. 气态氢化物稳定性 HX > H2Y > ZH3
C. 元素的非金属性 X > Y > Z D.单质的氧化性 X > Y > Z
例题2.下列叙述中,A金属性肯定比B金属性强的是 ( )
A.A原子的最外层电子数比B原子的最外层电子数少
B.A原子的电子层数比B原子的电子层数多
C.1 mol A从酸中置换出的H2比1 mol B从酸中置换出的H2多
D.常温时,A能从水中置换出H2,而B不能
例题3.X、Y是同周期的非金属元素,如果X原子半径比Y的大,下面说法正确的是 ( )
A.最高价氧化物对应水化物的酸性,X的比Y的强
B.X的非金属性比Y的强
C.X的阴离子比Y的阴离子还原性强
D.X的气态氢化物比Y的稳定
【课后习题】
1.( )X、Y、R、M均为短周期元素,X、Y同周期,X、Y两种元素最高价氧化物对应水化物化学式分别为H2XO4和HYO4。R、M同主族,R与冷水即可反应,M与热水反应缓慢。下列关系正确的是
A.原子半径X>Y B.氢化物稳定性H2X>HY
 C.原子核内质子数R<M D.溶液碱性R(OH)2<M(OH)2
C.原子核内质子数R<M D.溶液碱性R(OH)2<M(OH)2
2.( )短周期元素A、B、C、D的位置如右图所示,B、C两元素的原子序数之和是A元素的4倍,各元素对应的物质相互比较,其中关系正确的是
A.原子半径:C>D>A B.单质的熔点:B>C,D>A
C.最高正价:B>D=A>C D.气态氢化物的稳定性:B>C,D>A
3.( )X、Y、Z、W、R均是短周期元素,它们在元素周期表中的相对位置如图所示,其中W的最高正化合价与最低负化合价绝对值相等。下列说法正确的是
|
|
|
|
| X |
Y |
| Z | W |
| R |
①X、Y形成的某种化合物可作为呼吸面具中X2的来源
②气态氢化物的热稳定性:HmX>HmR>WHn
③Z、W、R分别与X形成的化合物的水化物都是强酸
④化合物YmX和YmR中,阳离子半径均大于阴离子半径
A.①② B.③④ C.①④ D.②③
4.( )几种短周期元素的原子半径及主要化合价如下表:
元素代号 | X | Y | Z | W |
原子半径/pm | 160 | 143 | 70 | 66 |
主要化合价 | +2 | +3 | +5、+3、-3 | -2 |
下列叙述正确的是
A.X、Y元素的金属性X<Y
B.一定条件下,Z单质与W的常见单质直接生成ZW2
C.Y的最高价氧化物的水化物能溶于稀氨水
D.一定条件下,W单质可以将Z单质从其氢化物中置换出来
5.在第三周期元素中,除稀有气体元素外:
⑴ 原子半径最小的元素是________(填元素符号)。
⑵ 金属性最强的元素是__________(填元素符号)。
⑶ 最高价氧化物对应水化物酸性最强的是__________(用化学式回答,下同)。
⑷ 最不稳定的气态氢化物是__________。
⑸ 最高价氧化物对应水化物碱性最强的是__________。
⑹ 氧化物中具有两性的是____________
1
第一章 元素周期表
班级 姓名 高一化学必修2![]()
第一章 物质结构 元素周期律
第二节 元素周期律
课时4 元素周期表和元素周期律的应用
 【知识清单】
【知识清单】
【知识建构】
三、元素周期表和元素周期律的应用
1.元素的金属性、非金属性与元素在周期表中位置的关系
认真观察下表,填空并画出金属与非金属的交界线,标出其附近的元素符号。
| 金属性逐渐 |
| IA | IIA | IIIA | IVA | VA | VIA | VIIA |
|
| 0 |
1 | 非金属性逐渐
|
| 非金属性逐渐 |
| ||||||||
2 |
|
|
|
|
|
|
|
| ||||
3 |
|
|
|
|
|
|
|
| ||||
4 |
|
|
|
|
|
|
|
| ||||
5 |
|
|
|
|
|
|
|
| ||||
6 |
|
|
|
|
|
|
|
| ||||
7 | 金属性逐渐
|
| ||||||||||
2. 元素化合价与元素在周期表中位置的关系
价电子:
主族序数= = =
非金属:最高正价+|最低负价| =
3.元素周期律、元素周期表的应用
(1)预测未知物的位置与性质
(2)寻找所需物质
① 根据同周期、同主族元素性质的递变规律可推知:金属性最强(不考虑放射性元素)的元素是 ,位于 ,非金属性最强的元素是 ,位于 。
② 位于分界线附近的元素既有 ,又有 ,如Al、Si、Ge等。
③ 在元素周期表 寻找用于制取农药的元素;在元素周期表 寻找催化剂、耐高温、耐腐蚀的合金材料;在元素周期表 寻找半导体材料。
【典型例题】
例题1.元素X原子的最外层有3个电子,元素Y原子的最外层有6个电子,这两种元素形成的化合物的化学式可能是(元素X、Y都为主族元素) ( )
A.XY2 B.X2Y3 C.X3Y2 D.X2Y
例题2. Ra(镭)是原子序数最大的第ⅡA族元素,下列说法不正确的是( )
A.原子半径是第ⅡA族中最大的 B.遇冷水能剧烈反应
C.位于第七周期 D.Ra(OH)2是两性氢氧化物
例题3.某元素x的最高价含氧酸的化学式为HnXO2n-2,则在某气态氢化物中,x元素的化合价为 ( )
A.一(12—5n) B.一(12—3n) C.一(6—3n) D.一(10一n)
例题4. 根据元素的原子结构或性质推测它在周期表中的位置。
处于同周期的相邻两种元素A和B,A的最高价氧化物的水化物的碱性比B弱,A处于B的 边(左或右);B的原子半径比A ;若B的最外层有2个电子,则A最外层有 个电子。
处于同周期的相邻两种元素A和B,A的最高价氧化物的水化物的酸性比B弱,A处于B的 边(左或右);B的原子半径比A ;若B的最外层有6个电子,则A最外层有 个电子。
【课后习题】
1.( )元素在周期表中的位置,反映了元素的原子结构和元素的性质。下列说法正确的是
A.同一元素不可能既表现金属性,又表现非金属性
B.第三周期元素的最高正化合价等于它所处的主族序数
C.短周期元素形成离子后,最外层都达到8电子稳定结构
D.同一主族元素的原子,最外层电子数相同,化学性质完全相同
2.( )课本第19页第2题
3.( )课本第19页第3题
4.( )X、Y、Z、W均为短周期元素,它们在周期表中的相对位置如右图所示。若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是
![]() A.原子半径:W>Z>Y>X
A.原子半径:W>Z>Y>X
B.最高价氧化物对应水化物的酸性W比Z弱
C.Y的气态氢化物的稳定性较Z的弱
D.四种元素的单质中,Z的熔、沸点最高
5.( )下列说法正确的是
A.SiH4比CH4稳定 B.O2―半径比F―的小
C.Na和Cs属于第ⅠA族元素,Cs失电子能力比Na的强
D.P和As属于第ⅤA族元素,H3PO4酸性比H3AsO4的弱
6.下表是元素周期表的一部分,回答相关的问题。
族 周期 | Ⅰ | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 |
|
|
|
| ① |
| ② |
|
3 | ③ | ④ | ⑤ | ⑥ |
| ⑦ | ⑧ | ⑨ |
(1)写出④的元素符号________________。
(2)在这些元素中,最活泼的金属元素与水反应的离子方程式__________ __________。
(3)在这些元素中,最高价氧化物的水化物酸性最强的是____________(填相应化学式,下同),碱性最强的是________________。
(4)这些元素中(除⑨外),原子半径最小的是________________(填元素符号,下同),原子半径最大的是________________。
*(5)②的单质与③的最高价氧化物的水化物的溶液反应,其产物之一是OX2,(O、X分别表示氧和②的元素符号,即OX2代表该化学式),该反应的离子方程式为(方程式中用具体元素符号表示) ______________________________________________。
7.(1)X元素的原子核外有2个电子层,其中L层有5个电子,该元素在周期表中的位置为______________________________________________,最高价氧化物的化学式为________,该元素的氢化物和最高价氧化物对应水化物反应的离子方程式为
________________________________________________________________________。
(2)Y为短周期元素,若其最高价氧化物对应水化物的化学式为HYO3,则此时Y元素的化合价为________,Y原子的最外层电子数为________,其气态氢化物的化学式为________。
1
第一章 元素周期表
班级 姓名 高一化学必修2![]()
第一章 物质结构 元素周期律
第三节 化学键
课时1 离子键
【知识建构】
一、 离子键
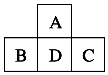
【实验】课本实验1—2 钠在氯气![]() 中燃烧
中燃烧![]()
现象 |
|
化学方程式 |
|
 (一)离子键
(一)离子键
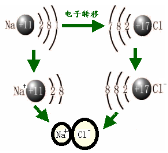
1.概念: 源作用叫做离子键。
2.成键因素
①成键微粒: 。
②成键本质: 。
③成键元素: 。源
3.形成条件
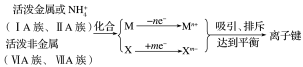
4.离子化合物
(1)离子化合物的概念 。
(2)常见的离子化合物的类型:
_________________________________________ __________ ______
_______________________ _____________________________________ ___
_ ________
总结:离子化合物中一定存在离子键,离子键只能存在于离子化合物中![]() 。
。
(二)电子式的书写
在元素符号的周围用小黑点·(或×)来表示原子 ![]() 的式子叫电子式。
的式子叫电子式。
1.表示原子
Na 、Mg 、Al 、C 、
N 、O 、Cl
2.表示简单离子:
阳离子:Na+ Mg2+ Al3+
阴离子:Cl­­- S2- O2- F-
3.表示![]() 离子化合物
离子化合物
NaCl MgO ![]()
MgCl2 Na2S
4.用电子式表示离子化合物的形成过程
NaCl: 。
MgBr2: 。
Na2S 。
【典型例题】
例1.下列哪组元素的原子之间反应容易形成离子键: ( )
原子 | a | b | c | d | e | f | g |
M电子层 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
A.a和c B.a和f C.b和g D.d和g
例2.下列说法正确的是 ( )
A.离子键就是阴阳离子间的静电引力
B.所有金属元素与所有非金属元素间都能形成离子键
C.钠原子与氯原子结合成氯化钠后体系能量降低
D.在离子化合物CaCl2中,两个氯离子间也存在离子键
例3.下列物质中属于离子化合物的是( )
A.苛性钠 B.碘化氢 C.硫酸 D.醋酸
例4.下列物质含有离子键的是( ![]() )
)
A.C12 B.NaCl C.CO2 D.H2O
例5.下列化合物的电子式书写正确的是( )

【课后习题】
1.( )下列物质中有离子键存在的是
A.N2 B.HCl C.H2SO4 D.NH4Cl
2.( )下列物质中有氧离子的是
A.氧化镁 B.一氧化氮 C.氯酸钾 D.硫酸
3.( )以下叙述中,错误的是
A.钠原子和氯原子作用生成NaCl后,其结构的稳定性增强
B.在氯化钠中,除氯离子和钠离子的静电吸引作用外,还存在电子与电子、原子核与原子核之间的排斥作用
C.任何离子键在形成的过程中必定有电子的得与失
D.金属钠与氯气反应生成氯化钠后,体系能量降低
4.( )下列微粒电子式错误的是

5.( )下列说法正确的是
A.凡是金属元素跟非金属元素化合形成的化合物都是离子化合物
B.离子化合物中的阳离子都是金属离子
C.离子化合物中,一个阴离子可同时与多个阳离子之间有静电作用
D.溶于水可以导电的化合物一定是离子化合物
*6.( )下列性质能证明某化合物内一定存在离子键的是
A.可溶于水 B.水溶液能导电
C.具有较高的熔点 D.熔融状态下能导电
7.按要求填写:
(1)一核10电子的原子的电子式 ;
(2)一核10电子的阳离子的符号 ;
(3)一核10电子的阴离子的电子式 ;
(4)两核10电子的化合物的化学式 ;
(5)三核10电子的化合物的化学式 。
8. A元素的最高价离子0.5 mol被还原成中性原子时,要得到6.02×1023个电子,它的单质同盐酸充分反应时,放出0.02 g H2,用去0.4 g A。B元素的原子核外电子层数与A相同,且B元素形成的单质是红棕色液体。
(1)写出两种元素的名称:A_____________;B_______________。
(2)用电子式表示A、B两元素常见离子:A______________,B______________。
9.用电子式表示下列物质的形成过程。
(1)Na2O
(2)CaBr2
(3)KF
1
第一章 元素周期表
班级 姓名 高一化学必修2![]()
第一章 物质结构 元素周期律
第三节 化学键
课时2 共价键
【知识清单】

【知识建构】
二、共价键
(一)共价键
1.定义:原子间通过____________________所形成的________________。
2.成键粒子:________。
3.成键元素:同种或不同种____________元素化合时能形成共价键。
4.存在
①非金属单质(除稀有气体),如H2、O2、N2、O3。
②共价化合物,如_________________________________________________。
③某些离子化合物,如___________________________________________。
5.分类
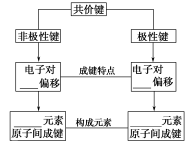
6.表示:
(1)电子式:如HCl____________、H2____________、H2O____________;
(2)结构式:如N2____________、HCl____________、CO2____________________。
(二)共价化合物
1.定义:以____________________形成的化合物。
2.用电子式表示形成过程:
H2O
CO2
NH3
CH4
H2O2
三、化学键
1.概念:使________相结合或________相结合的作用力。
2.形成类别
①原子间价电子的转移——____________。
②原子间价电子的共用——____________。
3.化学反应的本质:一个化学反应的发生,本质上就是________________________的过程。
【典型例题】
例1.判断正误,正确的打“√”,错误的打“×”
(1)由分子组成的物质中一定存在共价键( )
(2)由非金属元素组成的化合物一定是共价化合物( )
(3)离子化合物中一定不存在共价键( )
(4)含有共价键的化合物一定是共价化合物( )
(5)共价化合物中可能含有离子键( )
例2.分析下列物质中化学键的类型:
H2 O2 HCl
CO2 H2O2 NaOH
NH4Cl Na2O2 。
【课后习题】
1.( )下列叙述正确的是
A.两种非金属原子间不可能形成离子键;
B.非金属原子间不可能形成离子化合物
C.离子化合物中可能有共价键;
D.共价化合物中可能有离子键;
2.( )下列分子中所有原子都能满足最外层为8电子结构的是
A. BF3 B. H2O C. SiCl4 D. PCl5
3.( )下列物质中,不存在化学键的是
A.食盐 B.氯气 C.氦气 D.氨气
4.( )下列各组分子中,化学键类型不同的是
A.H2O、CO B.MgF2、H2O2 C.KOH、Mg(OH)2 D.HCl、HBr
5.( )下列变化过程中,共价键被破坏的是
A.冰变成水 B.氯化氢气体溶于水
C.乙醇溶于水 D.溴蒸气被木炭吸附
6.( )下列叙述中,正确的是
A.化学键只存在于分子之间
B.化学键是相邻原子或离子之间强烈的相互作用
C.化学键只存在于离子之间
D.化学键是相邻分子之间的强烈的相互作用
7.( )下列叙述不正确的是
A.两种元素构成的共价化合物分子中的化学键都是极性共价键
B.两种不同的非金属元素原子之间形成的化学键都是极性共价键
C.气态单质分子中一定含有非极性共价键
D.双原子单质分子中一定含有非极性共价键
8.在①CaCl2 ②KOH ③CO2 ④H2SO4 ⑤Na2O2 ⑥Na2S中,只含有离子键的是_______,只含有共价键的是_______,既含有离子键又含有共价键的是________,含有非极性键的是_________。(填写序号)
9.有A、B、C、D、E五种短周期元素,它们的核电荷数按C、A、B、D、E的顺序增大。C、D都能分别与A按个数比1︰1或2︰1形成化合物。CB可与EA2反应生成C2A与气态物质EB4。
(1)写出五种元素名称:A_______、B_______、C_______、D_______、E______;
(2)画出E的原子结构简图_____________,写出电子式:D2A2______________,EB4______________。
10.A+、B-、C2-、D、E、F、G分别表示含有18个电子的七种微粒(离子或分子),请回答:
(1)A元素是_________、B元素是__________、C元素是____________(用元素符号表示)。
(2)D是由两种元素组成的双原子分子,其分子式是____________。
(3)E是所有含18个电子的微粒中氧化能力最强的分子,其分子式是__________。
(4)F是由两种元素组成的三原子分子,其分子式是__________,电子式是__________。
(5)G分子中含有4个原子,其分子式是___________。
1
第一章 元素周期表
班级 姓名 高一化学必修2![]()
第一章 物质结构 元素周期律
复习课
【知识建构】
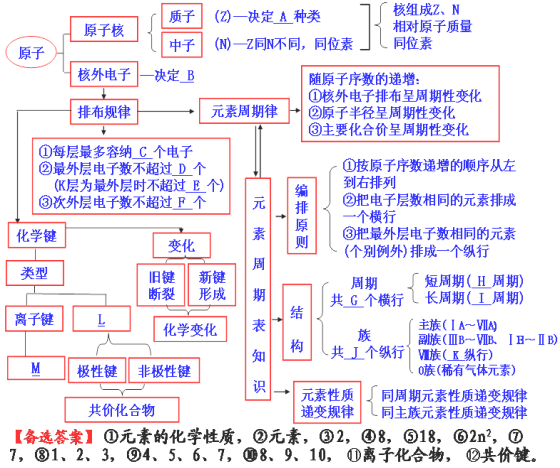 下图是本章的知识结构图,请从后面的备选答案中选择准确内容,填在框图中的相应位置。
下图是本章的知识结构图,请从后面的备选答案中选择准确内容,填在框图中的相应位置。
【典型例题】
 例题1.在元素周期表中的前四周期,两两相邻的5种元素如图所示,若B元素的核电荷数为a。下列说法正确的是( )
例题1.在元素周期表中的前四周期,两两相邻的5种元素如图所示,若B元素的核电荷数为a。下列说法正确的是( )
A.B、D的原子序数之差可能为2
B.E、B的原子序数之差可能是8、18或32
C.5种元素的核电荷总数之和可能为5a+10
D.A、E的原子序数之差可能是7
例题2. 金属钛对体液无毒且有惰性,能与肌肉和骨骼生长在一起,因而有“生物金属”之称。下列有关Ti和Ti的说法中正确的是( )
A.Ti和Ti原子中均含有22个中子
B.Ti和Ti核外均有4个电子层
C.分别由![]() Ti和Ti组成的金属钛单质互称为同位素
Ti和Ti组成的金属钛单质互称为同位素
D.Ti与Ti为同一核素
例题3. 下列不能说明氯元素的非金属性比硫元素强的事实是( )
①HCl比H2S稳定 ②HClO的氧化性比H2SO4强 ③HClO4的酸性比H2SO4强 ④Cl2能与H2S反应生成S ⑤Cl原子最外层有7个电子,S原子最外层只有6个电子 ⑥Cl2与Fe反应生成FeCl3,S与Fe反应生成FeS ⑦Cl与S为同周期元素,且Cl的核电荷数比S的大 ⑧HCl的水溶液比H2S的水溶液酸性强
A.①② B.②⑤⑧ C.②⑤⑦ D.①②④
例题4.下列结论错误的是( )
①微粒半径:K+>Al3+>S2->Cl-②氢化物的稳定性:HF>HCl>H2S>PH3>SiH4③离子的还原性:S2->Cl->Br->I-④氧化性:Cl2>S>Se>Te⑤酸性:H2SO4>H3PO4>H2CO3>HClO4⑥非金属性:O>N>P>Si⑦金属性:Be<Mg<Ca<K
A.只有① B.①③⑤ C.②④⑤⑥⑦ D.②④⑥
例题5.下表是元素周期表的一部分,有关说法正确的是( )
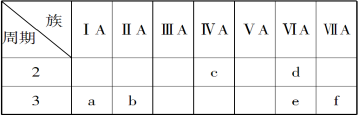
A.e的氢化物比d的氢化物稳定 B.a、b、e三种元素的原子半径:e>b>a
C.六种元素中,c元素单质的化学性质最活泼
D.c、e、f的最高价氧化物对应的水化物的酸性依次增强
例题6. (1)有下列物质:He、N2、CaO、CH4、Na2S、KOH、NaHCO3。①其中只含共价键的是___ _____;②只含离子键的是____ ____;③既含有共价键又含有离子键的是__ ______;④属于共价化合物的是__ ______;⑤属于离子化合物的是______ __。(填序号)
【课后习题】
1.( )已知R2+核外有a个电子,b个中子,表示R原子符号正确的是
A.R B.R C.R D.R
2.( )下列说法正确的是
A.Li是最活泼金属,F是最活泼非金属 B.Mg(OH)2碱性比Ca(OH)2强
C.元素周期表有7个主族,7个副族,1个0族,1个Ⅷ族,共16纵行
D.X2+的核外电子数目为18,则X在第四周期第ⅡA族
3.( )下列化学用语正确的是
A.CO2的电子式:C B.Mg2+的结构示意图:![]()
 C.Na2O的电子式:Na[]2- D.N2的电子式:
C.Na2O的电子式:Na[]2- D.N2的电子式:![]()
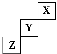
4.( )短周期元素X、Y、Z在元素周期表中的位置如图所示,下列说法正确的是
A.X、Y、Z三种元素中,X的非金属性最强 B.Y的最高正化合价为+7价
C.Y氢化物的稳定性比Z的氢化物弱 D.X单质的熔点比Z的低
5.( ) 下表是部分短周期元素的原子半径及主要化合价,根据表中信息,判断以下叙述正确的是
元素代号 | L | M | Q | R | T |
原子半径/nm | 0.160 | 0.143 | 0.089 | 0.102 | 0.074 |
主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
A.L2+与R2-的核外电子数相等
B.M与T形成的化合物既能与酸反应又能与强碱反应
C.氢化物的稳定性为H2T<H2R
D.单质与浓度相等的稀盐酸反应的速率为Q>L
6. X、Y、Z均为短周期元素,X元素的气态氢化物通入无色酚酞溶液,溶液变红,Y元素的最外层电子数是次外层电子数的3倍,Z元素是短周期元素中原子半径最大的元素(He、Ne、Ar除外)。
(1)Z元素的最高价氧化物对应的水化物的电子式为 ;
(2)X元素与Y元素最简单的气态氢化物的热稳定性顺序为 ;
(3)Y元素的最简单氢化物和Z元素的过氧化物发生反应的化学方程式为 。
7. X、Y、Z、W、R是短周期中的常见元素,其相关信息如下表:
元素 | 相关信息 |
X | 原子核内无中子 |
Y | 组成蛋白质的基础元素,其最高正化合价与最低负化合价的代数和为2 |
Z | 地壳中含量最高的元素 |
W | 原子质量数为23,中子数为12 |
R | 其离子是第三周期金属元素的离子中半径最小的 |
(1)Y、Z、W、R四种元素的原子半径从大到小的顺序是_ _____(用元素符号表示)。
(2) Y2电子式为 ;X、Y、Z形成的化合物可用作化肥,该物质所含化学键的类型是 (填“共价”或“离子”);X与Z形成的18e-微粒的结构式为 。
(3)砷(As)是人体必需的微量元素,与Y同一主族,As原子比Y原子多两个电子层,则砷的原子序数为________,其最高价氧化物的化学式为____________。该族第二到四周期元素的气态氢化物的稳定性从大到小的顺序是___ ___(用化学式表示)。
(4)W在元素周期表中的位置为_ ______;能够说明W和R金属性强弱的依据有 。
a. W单质的熔点比R单质的熔点低 b.W的化合价比R的低
c.常温下W单质与水的反应很剧烈,而R单质在加热条件下与水反应现象不明显
d.W最高价氧化物的水化物的碱性比R强
1
第一章 元素周期表
版权所有:南京市江宁高级中学 Copyright © 1999-2017 ALL Rights Reserved
信息发布:校务办公室 技术支持:信息中心 储老师