2015年高考上海化学试题解析
相对原子质量:H-1 C-12 N-14 O-16 Na-23 Cl-35.5 Ca-40
中国科学技术名词审定委员会已确定第116号元素293 116Lv的名称为鉝。关于的叙述错误的是
A. 原子序数116B. 中子数177
C. 核外电子数116D. 相对原子质量293
D
解析:考察核素。根据原子构成,原子序数116,核外电子数116,中子数177,质量
数为293,但Lv还有别的同位素,相对原子质量是加权平均值。D错,选择D。
2. 下列物质见光不会分解的是
A. HClOB. NH4ClC. HNO3D. AgNO3
B
解析:考察物质见光的稳定性。HClO、HNO3、 AgNO3见光分解, NH4Cl不分解。
选择B。
3. 某晶体中含有极性键,关于该晶体的说法错误的是
A. 不可能有很高的熔沸点B. 不可能是单质
C. 可能是有机物D. 可能是离子晶体
B
解析:考察化学键类型和晶体类型、物质类别和熔点沸点的关系。晶体中含有极性键,
可能是离子晶体,也可能是原子晶体,也可能是分子晶体,如KOH、SiO2、H2O;在原子晶体中,有很高的熔沸点,在分子晶体中可能是有机物。单质是同种元素组成的纯净物,没有极性键,选择B。
4. 不能作为判断硫、氯两种元素非金属性强弱的依据是
A. 单质氧化性的强弱B. 单质沸点的高低
C. 单质与氢气化合的难易D. 最高价氧化物对应的水化物酸性的强弱
B
解析:考察元素周期律。S、Cl同周期,可以用单质氧化性的强弱,单质与氢气化合的
难易,最高价氧化物对应的水化物酸性的强弱比较非金属性强弱,不能用沸点熔点衡量。选择B。
5. 二氧化硫能使溴水褪色,说明二氧化硫具有
A. 还原性B. 氧化性C. 漂白性D. 酸性
A
解析:考察二氧化硫的性质。二氧化硫能使溴水褪色,SO2+Br2+2H2O===H2SO4+2HBr,
体现二氧化硫的还原性。选择A。
6. 将Na、Na2O、NaOH、Na2S、Na2SO4分别加热熔化,需要克服相同类型作用力的物质有
A. 2种B. 3种C. 4种D. 5种
解析:考察作用力类型。加热熔化,Na克服金属键,NaOH、Na2S、Na2SO4克服离子
键,3种相同。选择B。
7. 检验用硫酸亚铁制得的硫酸铁中是否含有硫酸亚铁,可选用的试剂是
A. NaOHB. KMnO4C. KSCND. 苯酚
B
解析:考察Fe2+在Fe3+存在下的检验,可以用KMnO4,也可以用铁氰化钾。选择B。
8.  已知H2O2在催化剂作用下分解速率加快,其能量随反应进程的变化如下图所示。下列说法正确的是
已知H2O2在催化剂作用下分解速率加快,其能量随反应进程的变化如下图所示。下列说法正确的是
A. 加入催化剂,减小了反应的热效应
B. 加入催化剂,可提高H2O2的平衡转化率
C. H2O2分解的热化学方程式:H2O2 → H2O + O2 + Q
D. 反应物的总能量高于生成物的总能量
D
解析:考察催化剂的作用。加入催化剂,降低活化能,加快反应速率,不改变平衡转化
率。是放热反应,反应物的总能量高于生成物的总能量,热化学方程式但没有注明物质状态。选择D。
9. 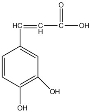 已知咖啡酸的结构如右图所示。关于咖啡酸的描述正确的是
已知咖啡酸的结构如右图所示。关于咖啡酸的描述正确的是
A. 分子式为C9H5O4
B. 1mol咖啡酸最多可与5mol氢气发生加成反应
C. 与溴水既能发生取代反应,又能发生加成反应
D. 能与Na2CO3溶液反应,但不能与NaHCO3溶液反应
C
解析:考察有机结构与性质的关系。分子式为C9H8O4,含有苯环和碳碳双键,可以加
成,1mol咖啡酸最多可与4mol氢气发生加成反应,碳碳双键可以与溴水加成,酚羟基的邻位对位可以溴水既能发生取代,有羧基与Na2CO3溶液、NaHCO3溶液都可以反应,酚羟基反能与Na2CO3溶液反应。选择C。
10. 卤代烃的制备有多种方法,下列卤代烃不适合由相应的烃经卤代反应制得的是
A. ![]() B.
B. 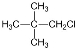 C.
C. 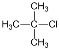 D.
D. 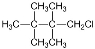
C
解析:考察有机制备方法。实质是考察同分异构问题,环己烷、2,2-二甲基丙烷、2,
2,3,3-四甲基丁烷一氯代只有一种,2-甲基丙烷的氯代有两种,副产物多。选择C。
11. 下列有关物质性质的比较,错误的是
A. 溶解度:小苏打 < 苏打B. 密度:溴乙烷 > 水
C. 硬度:晶体硅 < 金刚石D. 碳碳键键长:乙烯 > 苯
D
解析:考察物质性质的比较。溶解度:小苏打 < 苏打;密度:溴乙烷 > 水,硬度:
晶体硅 < 金刚石, 碳碳键键长:乙烯 < 苯。选择D。
12.与氢硫酸反应有沉淀生成的电解质是
A. 硫酸铜B. 氢氧化钠C. 硫酸亚铁D. 二氧化硫
A
解析:考察硫化氢的性质。A、CuSO4+H2S===CuS↓+H2SO4,生成CuS沉淀,B,不生成沉淀,C,不反应;D,生成S沉淀,但二氧化硫是非电解质。选择A。
13.实验室回收废水中苯酚的过程如右图所示。下列分析错误的是
A. 操作I中苯作萃取剂
B. 苯酚钠在苯中的溶解度比在水中的大
C. 通过操作II苯可循环使用
D. 三步操作均需要分液漏斗
B
解析:考察分离提纯方法。苯酚钠是盐,在苯中的溶解度比在水中的小。选择B
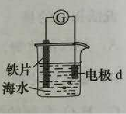 14.研究电化学腐蚀及防护的装置如右图所示。下列有关说法错误的是
14.研究电化学腐蚀及防护的装置如右图所示。下列有关说法错误的是
A. d为石墨,铁片腐蚀加快
B. d为石墨,石墨上电极反应为:O2 + 2H2O + 4e → 4OH–
C. d为锌块,铁片不易被腐蚀
D. d为锌块,铁片上电极反应为:2H+ + 2e → H2↑
D
解析:考察电化学腐蚀及防护。Fe-C原电池,加快Fe腐蚀,为吸氧腐蚀,AB正确,Fe-Zn原电池,铁片不易被腐蚀,是Zn腐蚀,依旧是吸氧腐蚀。C正确,D错误。选择D。
15.一般情况下,前者无法决定后者的是
A. 原子核外电子排布——元素在周期表中的位置
B. 弱电解质的相对强弱——电离常数的大小
C. 分子间作用力的大小——分子稳定性的高低
D. 物质内部储存的能量——化学反应的热效应
C
解析:考察物质结构与性质的关系。原子核外电子排布决定元素在周期表中的位置,弱电解质的相对强弱决定电离常数的大小,物质内部储存的能量决定化学反应的热效应,分子间作用力的大小决定熔点沸点高低,分子稳定性的高低由化学键强弱决定。选择C。
16.短周期元素甲、乙、丙、丁的原子序数依次增大,甲和丁的原子核外均有两个未成对电子,乙、丙、丁最高价氧化物对应的水化物两两之间能相互反应。下列说法错误的是
A. 元素丙的单质可用于冶炼金属B. 甲与丁形成的分子中由非极性分子
C. 简单离子半径:丁 > 乙 > 丙 D. 甲与乙形成的化合物均有氧化性
D
解析:考察元素推断与元素周期律。乙、丙、丁最高价氧化物对应的水化物两两之间能相互反应,丙是Al,甲和丁的原子核外均有两个未成对电子,甲是C或O,丁是S,乙是Na。Al可以用铝热反应制备金属,CS2是非极性分子,离子半径:S2->Na+>Al3+,Na2O不具有氧化性,Na2O2具有。选择D。
17.某无色溶液含有下列离子中的若干种:H+、NH4+、Fe3+、Ba2+、Al3+、CO32–、Cl–、OH–、NO3–。向该溶液中加入铝粉,只放出H2,则溶液中能大量存在的离子最多有
A. 3种B. 4种C. 5种D. 6种
C
解析:考察铝的化学性质和离子共存问题。无色溶液,排除Fe3+;向该溶液中加入铝粉,只放出H2,可能是酸溶液,CO32–、OH–不存在,NO3–不产生氢气,5种;如果是强碱溶液,
H+、NH4+、Al3+、不能大量共存,5种,选择C。
18.下列反应中的氨与反应4NH3 + 5O2 → 4NO + 6H2O中的氨作用相同的是
A. 2Na + 2NH3 → 2NaNH2 + H2↑B. 2NH3 + 3CuO → 3Cu + N2 +3H2O
C. 4NH3 + 6NO → 5N2 + 6H2OD. 3SiH4 + 4NH3 → Si3N4 + 12H2
BC
解析:考察氨的化学性质。4NH3 + 5O2 → 4NO + 6H2O,氨体现还原性,A体现氧化性,
B体现还原性,C体现还原性,D体现氧化性。选择BC。
19.离子方程式2Ca2+ + 3HCO3– + 3OH– → 2CaCO3↓ + CO32– + 3H2O可以表示
A. Ca(HCO3)2与NaOH溶液反应B. NaHCO3与澄清石灰水反应
C. Ca(HCO3)2与澄清石灰水反应D. NH4HCO3与澄清石灰水反应
AB
解析:考察离子反应的本质。2Ca2+ + 3HCO3– + 3OH– → 2CaCO3↓ + CO32– + 3H2O实质
是HCO3– + 2OH– → CO32– + H2O和Ca2+ + CO32– → CaCO3↓的组合。AB正确,C,全部
产生CaCO3,D,铵离子可能参加反应。选择AB。
20.对于合成氨反应,达到平衡后,以下分析正确的是
A. 升高温度,对正反应的反应速率影响更大
B. 增大压强,对正反应的反应速率影响更大
C. 减小反应物浓度,对逆反应的反应速率影响更大
D. 加入催化剂,对逆反应的反应速率影响更大
BC
解析:考察合成氨的化学平衡。N2(g)+3H2(g)![]() 2NH3(g)+Q,升高温度,平衡逆向移
2NH3(g)+Q,升高温度,平衡逆向移
动,对吸热反应的速率影响更大;增大压强,平衡正向移动,对正反应的反应速率影响更大;
减小反应物浓度,平衡逆向移动,对逆反应的反应速率影响更大;加入催化剂,平衡不移动
对正逆反应的反应速率影响同样大。选择BC。
21.工业上将Na2CO3和Na2S以1:2的物质的量之比配成溶液,再通入SO2,可制取Na2S2O3,同时放出CO2。在该反应中
A. 硫元素既被氧化又被还原
B. 氧化剂与还原剂的物质的量之比为1:2
C. 每生成1molNa2S2O3,转移4mol电子
D. 相同条件下,每吸收10m3SO2就会放出2.5m3CO2
AD
解析:考察氧化还原反应。根据信息,Na2CO3+2Na2S+4SO2===3Na2S2O3+CO2↑;
Na2S中S被氧化,SO2中S被还原;氧化剂与还原剂的物质的量之比为2:1;每生成
1molNa2S2O3,转移2mol电子;相同条件下,每吸收10m3SO2就会放出2.5m3CO2。选择AD。
22.将O2和NH3的混合气体448mL通过加热的三氧化二铬,充分反应后,再通过足量的水,最终收集到44.8mL气体。原混合气体中O2的体积可能是(假设氨全部被氧化;气体体积均已换算成标准状况)
A. 231.5mLB. 268.8mLC. 287.5mL D. 313.6mL
CD
解析:考察氧化还原的计算。根据,4NH3+5O2![]() 4NO+6H2O,4NO+3O2+
4NO+6H2O,4NO+3O2+
2H2O===4HNO3;总反应,NH3+2O2===HNO3+H2O;
如果剩余是NO,V(O2)+V(NH3)=448,8[V(NH3)-44.8]+44.8×5=V(O2)×4,
V(NH3)=160.5mL,,V(O2)=448-160.5=287.5L;如果氧气过量,V(O2)+V(NH3)=448,
8V(NH3)=4[448-44.8-V(NH3)],V(NH3)=134.4mL,V(O2)=448-134.4=313.6mL。选择CD。
白云石的主要成份是CaCO3·MgCO3,在我国有大量的分布。以白云石为原料生产的钙镁系列产品有广泛的用途。白云石经煅烧、消化后得到钙镁的氢氧化物,再经过碳化实现Ca2+、Mg2+的分离。碳化反应是放热反应,化学方程式如下:
Ca(OH)2 + Mg(OH)2 + 3CO2 ? CaCO3 + Mg(HCO3)2 + H2O
完成下列填空
23.Ca(OH)2的碱性比Mg(OH)2的碱性 (选填“强”或“弱”)
Ca(OH)2的溶解度比Mg(OH)2的溶解度 (选填“大”或“小”)
24.碳化温度保持在50~60℃。温度偏高不利于碳化反应,原因是 、 。温度偏低也不利于碳化反应,原因是 。
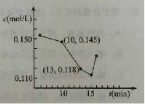 25.已知某次碳化时溶液中钙离子浓度随时间的变化如右图所
25.已知某次碳化时溶液中钙离子浓度随时间的变化如右图所
示,在10 min到13 min之内钙离子的反应速率为
。25. min之后钙离子浓度增大,原因是
(用化学方程式表示)。
26.Mg原子核外电子排布式为 ;Ca原子最外层电子
的能量 Mg原子最外层电子的能量。(选填“低于”、“高于”或“等于”)
解析:以白云石为背景考察元素周期律,反应原理、反应速率、平衡移动、电子排布知识。(1)Ca、Mg同主族,Ca(OH)2的碱性比Mg(OH)2的碱性强,Ca(OH)2的溶解度比Mg(OH)2的溶解度大;(2)碳化温度保持在50~60℃,温度偏高不利于碳化反应,二氧化碳挥发,平衡逆向移动。温度偏低也不利于碳化反应,二氧化碳溶解增多,CaCO3与二氧化碳反应,不利于Ca2+、Mg2+的分离;(3)根据图像信息,10 min到13 min之内,υ(Ca2+)=
=0.009mol·L-1·min-1;15 min之后钙离子浓度增大,是因为CaCO3+CO2+H2O===Ca2++2HCO3-;(4)Mg的电子排布式为1s22s22p63s2,Ca比Mg多一个电子层,原子最外层电子的能量高于Mg原子最外层电子的能量。
参考答案:
23、强;大;
24、温度过高,二氧化碳挥发,平衡逆向移动。温度过低,二氧化碳溶解增多,CaCO3与二氧化碳反应,不利于Ca2+、Mg2+的分离;
25、0.009mol·L-1·min-1;CaCO3+CO2+H2O===Ca2++2HCO3-;
26、1s22s22p63s2;高
五、(本题共12分)
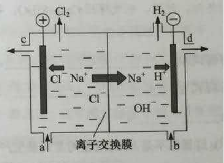
氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品。下图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过。
完成下列填空:
27.写出电解饱和食盐水的离子方程式。
28.离子交换膜的作用为: 、 。
29.精制饱和食盐水从图中 位置补充,氢氧化钠溶液从图中 位置流出。(选填“a”、“b”、“c”或“d”)
30.KClO3可以和草酸(H2C2O4)、硫酸反应生成高效的消毒杀菌剂ClO2,还生成CO2和KHSO4等物质。写出该反应的化学方程式
31.室温下,0.1 mol/L NaClO溶液的pH 0.1 mol/L Na2SO3溶液的pH。(选填“大于”、“小于”或“等于”)
浓度均为0.1 mol/L 的Na2SO3和Na2CO3的混合溶液中,SO32–、CO32–、HSO3–、HCO3– 浓度从大到小的顺序为 。
已知:H2SO3Ki1=1.54×10-2Ki2=1.02×10-7
HClOKi1=2.95×10-8
H2CO3Ki1=4.3×10-7Ki2=5.6×10-11
解析:以氯碱工业考察反应原理、离子交换膜、电解原理、氧化还原和离子浓度比较。27、电解饱和氯化钠溶液:2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑;28、离子交换膜的作用是让Na+通过平衡离子的电荷,防止OH-与氯气反应,防止氢气与氯气反应;29、阳极反应式为:2Cl--2e-===Cl2↑,精制饱和食盐水从a处补充,阴极反应式为2H2O+2e-===H2↑+2OH-,氢氧化钠溶液从d处流出;30、KClO3可以和草酸(H2C2O4)、硫酸反应,
2OH-+H2↑+Cl2↑;28、离子交换膜的作用是让Na+通过平衡离子的电荷,防止OH-与氯气反应,防止氢气与氯气反应;29、阳极反应式为:2Cl--2e-===Cl2↑,精制饱和食盐水从a处补充,阴极反应式为2H2O+2e-===H2↑+2OH-,氢氧化钠溶液从d处流出;30、KClO3可以和草酸(H2C2O4)、硫酸反应,
2KClO3+H2C2O4+2H2SO4===2ClO2+CO2↑+2KHSO4+2H2O;31、因为,HClO的电离平
衡常数小于HSO3-的电离平衡常数,碱性NaClO> Na2SO3;HSO3-的衡常数大于HCO3-的
电离平衡常数,CO32-水解能力强于CO32-,离子浓度:C(SO32–)>C(CO32–)>C(HCO3-)
>C(HSO3-)。
参考答案:
27、2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑;
2OH-+H2↑+Cl2↑;
28、让Na+通过平衡离子的电荷并导电,防止OH-与氯气反应,防止氢气与氯气反应;
29、a;d;
30、2KClO3+H2C2O4+2H2SO4===2ClO2+CO2↑+2KHSO4+2H2O;
31、大于;:C(SO32–)>C(CO32–)>C(HCO3-)>C(HSO3-)。
过氧化钙(CaO2)是一种白色、无毒、难溶于水的固体,能杀菌消毒,广泛用于果蔬保鲜、空气净化、污水处理等方面。工业生产过程如下:
① 在NH4Cl溶液中加入Ca(OH)2;
② 不断搅拌的同时加入30% H2O2,反应生成CaO2·8H2O沉淀;
③ 经过陈化、过滤,水洗得到CaO2·8H2O,再脱水干燥得到CaO2。
完成下列填空
32.第①步反应的化学方程式为 。
第②步反应的化学方程式为 。
33.可循环使用的物质是 。
工业上常采用Ca(OH)2过量而不是H2O2过量的方式来生产,这是因为 。
34.检验CaO2·8H2O是否洗净的方法是 。
35.CaO2·8H2O加热脱水的过程中,需不断通入不含二氧化碳的氧气,
目的是 、 。
36.已知CaO2在350℃迅速分解生成CaO和O2。下图是实验室测定产品中CaO2含量的装置(夹持装置省略)。
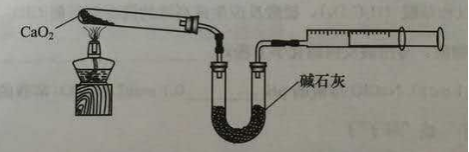
若所取产品质量是m g,测得气体体积为V mL(已换算成标准状况),则产品中CaO2的质量分数为 (用字母表示)。
过氧化钙的含量也可用重量法测定,需要测定的物理量有 。
解析:以过氧化钙为背景考察反应原理,洗涤方法,实验设计,化学计算等。32,NH4Cl溶液中加入Ca(OH)2反应:2NH4Cl+Ca(OH)2===CaCl2+2NH3·H2O;再加入双氧水,反应为CaCl2+2NH3·H2O+H2O2+6H2O===CaO2·8H2O+NH4Cl;33,根据反应原理,可循环使用的物质是NH4Cl;因为H2O2![]() H++HO2-,HO2-
H++HO2-,HO2-![]() H++O2-,Ca(OH)2过量,促使平衡正向移动,有利于CaO2·8H2O生成。34,实质是检验Cl-,取最后洗涤液,加入稀硝酸酸化,再加入硝酸银溶液,没有白色沉淀生成,证明洗涤干净;35,不断通入不含二氧化碳的氧气,防止CaO2与水反应、二氧化碳反应,并将水蒸汽带出;36,根据装置图,2CaO2~O2,
H++O2-,Ca(OH)2过量,促使平衡正向移动,有利于CaO2·8H2O生成。34,实质是检验Cl-,取最后洗涤液,加入稀硝酸酸化,再加入硝酸银溶液,没有白色沉淀生成,证明洗涤干净;35,不断通入不含二氧化碳的氧气,防止CaO2与水反应、二氧化碳反应,并将水蒸汽带出;36,根据装置图,2CaO2~O2,
ω(CaO2)=×100%=×100%。如果同样的装置用测定重量法,需要测定的物理量是固体加热前后的质量。
参考答案:
32、2NH4Cl+Ca(OH)2===CaCl2+2NH3·H2O;
CaCl2+2NH3·H2O+H2O2+6H2O===CaO2·8H2O+NH4Cl;
33、NH4Cl;Ca(OH)2过量,促使平衡朝有利于CaO2·8H2O生成的方向移动。
34、取最后洗涤液,加入稀硝酸酸化,再加入硝酸银溶液,没有白色沉淀生成,证明洗涤干净;
35、防止CaO2与水反应、二氧化碳反应,将水蒸汽带出;
36、×100%。固体加热前后的质量。
甲醛是深受关注的有机化合物。甲醛含量的测定有多种方法,例如:在调至中性的亚硫酸钠溶液中加入甲醛水溶液,经充分反应后,产生的氢氧化钠的物质的量与甲醛的物质的量相等,然后用已知浓度的硫酸滴定氢氧化钠。
完成下列填空:
37.将4.00 mL甲醛水溶液加入到经调至中性的亚硫酸钠溶液中,充分反应后,用浓度为1.100 mol/L的硫酸滴定,至终点时耗用硫酸20.00 mL。
甲醛水溶液的浓度为 mol/L。
38.上述滴定中,若滴定管规格为50mL,甲醛水溶液取样不能超过 mL。
39.工业甲醛含量测定的另一种方法:在甲醛水溶液中加入过氧化氢,将甲醛氧化为甲酸,然后用已知浓度的氢氧化钠溶液滴定。
HCHO + H2O2 → HCOOH + H2O
NaOH + HCOOH → HCOONa + H2O
已知H2O2能氧化甲酸生成二氧化碳和水。
如果H2O2用量不足,会导致甲醛含量的测定结果 (选填“偏高”、“偏低”或“不受影响”),因为 ;如果H2O2过量,会导致甲醛含量的测定结果 (选填“偏高”、“偏低”或“不受影响”),因为 。
40.甲醛和新制氢氧化铜的反应显示了甲醛的还原性,发生反应的化学方程式通常表示如下:
HCHO + 2 Cu(OH)2 HCOOH + Cu2O↓ + 2H2O
若向足量新制氢氧化铜中加入少量甲醛,充分反应,甲醛的氧化产物不是甲酸或甲酸盐,
设计一个简单实验验证这一判断。
①主要仪器:试管酒精灯
②可供选用的试剂:硫酸铜溶液甲醛甲酸氢氧化钠溶液
解析:甲醛含量的测定考察化学计算。37,根据亚硫酸钠溶液中加入甲醛水溶液的反应:HCHO+Na2SO3+H2O===NaHOCH2SO3+NaOH,C(HCHO)==11.00mol/L;38,若滴定管规格为50mL,甲醛水溶液取样不能超过50.00mL;39,根据反应原理,H2O2不足,生成的HCOOH减小,消耗的NaOH的体积减小,测定甲醛含量偏低;如果H2O2过量,H2O2与NaOH反应,消耗消耗的NaOH的体积增大,测定甲醛含量偏高;40,实质是醛基的检验,向试管中加入NaOH溶液,加入几滴硫酸铜溶液,再加入少量的产物,加热,没有红色沉淀生成,甲醛的氧化产物不是甲酸或甲酸盐。
参考答案:
37、11.00mol/L;
38、50.00;
39、偏低;H2O2不足,生成的HCOOH减小,消耗的NaOH的体积减小,
偏高;H2O2过量,H2O2与NaOH反应,消耗消耗的NaOH的体积增大,
40、向试管中加入NaOH溶液,加入几滴硫酸铜溶液,再加入少量的产物,加热,没有红色沉淀生成,甲醛的氧化产物不是甲酸或甲酸盐。
对溴苯乙烯与丙烯的共聚物是一种高分子阻燃剂,具有低毒、热稳定性好等优点。
完成下列填空:
41.写出该共聚物的结构简式。
42.实验室由乙苯制取对溴苯乙烯,需先经两步反应制得中间体![]() 。
。
写出该两步反应所需的试剂及条件。
43.将![]() 与足量氢氧化钠溶液共热得到A,A在酸性条件下遇FeCl3溶液不显色。
与足量氢氧化钠溶液共热得到A,A在酸性条件下遇FeCl3溶液不显色。
A的结构简式为 。
由上述反应可推知 。
由A生成对溴苯乙烯的反应条件为 。
![]() 44.丙烯催化二聚得到2,3-二甲基-1-丁烯,B与2,3-二甲基-1-丁烯互为同分异构体,且所有碳原子处于同一平面。
44.丙烯催化二聚得到2,3-二甲基-1-丁烯,B与2,3-二甲基-1-丁烯互为同分异构体,且所有碳原子处于同一平面。
写出B的结构简式。
设计一条由2,3-二甲基-1-丁烯制备B的合成路线。
(合成路线常用的表示方式为:![]() )
)
解析:考察有机基础知识。41, 与CH3CH=CH2的加聚产物是
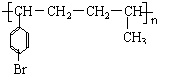
, ;42,第一步是溴和溴化铁,发生苯环的取代反应第二步溴蒸汽,光照,发生支链的取代反应;43,中间体
足量氢氧化钠溶液共热是—Br被—OH取代,A在酸性条件下遇FeCl3溶液不显
色。证明苯环上的Br未被取代;A再与浓硫酸共热消去得到对溴苯乙烯;44,2,3-二甲基-1-丁烯为(CH3)2CHC(CH3)=CH2,其同分异构体B所有碳原子处于同一平面,则B是
 (CH3)2C=C(CH3)2;由2,3-二甲基-1-丁烯制备B,可以先与HBr加成,再与NaOH醇溶液共热。
(CH3)2C=C(CH3)2;由2,3-二甲基-1-丁烯制备B,可以先与HBr加成,再与NaOH醇溶液共热。
参考答案:
41、
![]() 42、溴和溴化铁;溴蒸汽,光照;
42、溴和溴化铁;溴蒸汽,光照;
43、
44、(CH3)2C=C(CH3)2;
(CH3)2CHC(CH3)=CH2![]() (CH3)2CHCBr(CH3)CH3
(CH3)2CHCBr(CH3)CH3![]() (CH3)2C=C(CH3)2;
(CH3)2C=C(CH3)2;
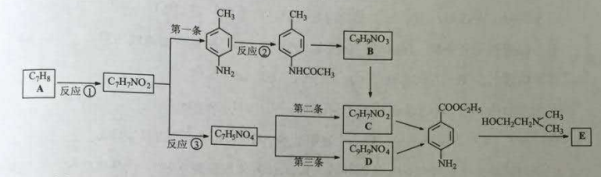
局部麻醉药普鲁卡因E(结构简式为![]() )的三条合成路线如下图所示(部分反应试剂和条件已省略):
)的三条合成路线如下图所示(部分反应试剂和条件已省略):
完成下列填空:
45.比A多一个碳原子,且一溴代物只有3种的A的同系物的名称是 。
46.写出反应试剂和反应条件。反应① ③
47.设计反应②的目的是 。
48.B的结构简式为 ;C的名称是 。
49.写出一种满足下列条件的D的同分异构体的结构简式。
①芳香族化合物②能发生水解反应③有3种不同环境的氢原子
1 mol该物质与NaOH溶液共热最多消耗 mol NaOH。
50.普鲁卡因的三条合成路线中,第一条合成路线与第二条、第三条相比不太理想,理由是 。
解析:考察有机合成。45,A的分子式为C7H8,是甲苯,比A多一个C原子是C8H10,且一溴代物只有3种的A的同系物的是邻二甲苯;46,甲苯与浓硝酸、浓硫酸共热发生硝化反应,生成对硝基甲苯,在与酸性高锰酸钾氧化变成对硝基苯甲酸;47,设计②的目的是保护氨基不被氧化;48,根据第一条合成路线,B是—CH3被氧化生成—COOH的产物;根据第第二条合成路线,C是对氨基苯甲酸;47,根据第第二条合成路线,是与乙醇在浓硫酸条件下发生酯化反应的产物,有苯环,是芳香族化合物;有酯基能够发生水解反应;有4种不同环境的氢原子;选择①②。1 mol该物质与NaOH溶液共热最多消耗1mol NaOH。50,相比较,第一条合成路线不太理想,是因为—NHCOCH3容易被酸性高锰酸钾氧化。
45、邻二甲苯;
46、浓硝酸、浓硫酸共热;酸性高锰酸钾溶液;
47、保护氨基不被氧化;
![]() 48、 ;对氨基苯甲酸;
48、 ;对氨基苯甲酸;
49、①②。1;
50、—NHCOCH3容易被酸性高锰酸钾氧化。
氨碱法制纯碱包括石灰石分解、粗盐水精制、氨盐水碳酸化等基本步骤。
完成下列计算:
51.CaCO3质量分数为0.90的石灰石100 kg完成分解产生CO2 L(标准状况)。
石灰窑中,该石灰石100 kg与焦炭混合焙烧,产生CO2 29120 L(标准状况),
如果石灰石中碳酸钙完全分解,且焦炭完全燃烧,不产生CO,则焦炭的物质的量为 mol。
52.已知粗盐水含MgCl2 6.80 mol/m3,含CaCl2 3.00mol/m3。
向粗盐水中加入Ca(OH)2除镁离子:MgCl2 + Ca(OH)2 → Mg(OH)2↓ + CaCl2
然后加入Na2CO3除钙离子。
处理上述粗盐水10 m3,至少需要加Na2CO3 g。
如果用碳酸化尾气(含NH3体积分数为0.100、CO2体积分数0.040)代替碳酸钠,发生如下反应:
Ca2+ + 2NH3 + CO2 + H2O → CaCO3↓ + 2NH4+
处理上述10 m3粗盐水至少需要通入多少L(标准状况)碳酸化尾气?列式计算。
53.某氨盐水含氯化钠1521 kg,通入二氧化碳后析出碳酸氢钠晶体,过滤后溶液中含氯化铵1070 kg。列式计算:
1) 过滤后溶液中氯化钠的质量。
2) 析出的碳酸氢钠晶体的质量。
解析:考察化学计算。51、根据.CaCO3~CO2,V(CO2)=×22.4=20160L;
再根据:C~CO2,m(C)==400mol;52,根据MgCl2 ~Ca(OH)2, 除去Mg2+消耗Ca(OH)2:n(Ca(OH)2)=10×6.8=68mol,根据Na2CO3~Ca2+,n(Na2CO3)=3.00×10+68
=98mol,m(Na2CO3)=98×106=10388g;根据Ca2+ ~2NH3 ~CO2 关系,氨气过量,
V(碳酸化尾气)==54880L;53,根据:NH3+CO2+NaCl===NaHCO3↓+NH4Cl,反应的NaCl的质量为:×58.5=1170kg,溶液中氯化钠的质量=1521-1170=351kg;根据钠守恒,析出碳酸氢钠晶体的质量为:20×84=1680kg。
参考答案:
51、20160;400;
52、10388;=54880L;
53、反应的NaCl的质量为:×58.5=1170kg,
溶液中氯化钠的质量=1521-1170=351kg;
析出碳酸氢钠晶体的质量为:20×84=1680kg。
版权所有:南京市江宁高级中学 Copyright © 1999-2017 ALL Rights Reserved
信息发布:校务办公室 技术支持:信息中心 储老师