“扬子石化杯”
第31届中国化学奥林匹克竞赛(江苏赛区)初赛试卷
可能用到的相对原子质量:H:1 C:12 N:14 O:16 Na:23 Al:27 Si:28 Cl:35.5 Fe:56 Co:59 Cu:64 Ag:108
题号 | 一 | 二 | 三 | 四 | 五 | 总分 | 核分人 |
得分 |
|
|
|
|
|
|
|
1.本试卷共22题,用2小时完成,共120分。2.不可使用计算器。
3.用铅笔作答无效。 4.不可使用涂改液或修正带。
一、选择题(每小题有1~2个选项符合题意,每小题4分,共60分。若有两个正确选项,选错一个得0分,少选一个得2分。请将答案填在下方的表格内。)
题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 得分 | 阅卷人 |
答案 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1.中国古代著作中有许多涉及化学的叙述,是中华民族智慧的结晶。下列解读正确的是
A.《汉书》中“高奴县有洧水可燃”,洧水指汽油
B.《天工开物》中“凡石灰,经火焚炼为用”,“石灰”指碳酸钙
C.《本草纲目》中“冬月灶中所烧薪柴之灰,令人以灰淋汁,取碱浣衣”,碱指烧碱
D.《淮南万毕术》中“曾青得铁则化为铜”,“曾青”是硫酸铜溶液
2.下列化学用语表示正确的是
A.中子数为8的氮原子:![]() B.硫离子的结构示意图:
B.硫离子的结构示意图:![]()
C.铵根离子的电子式: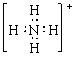 D.聚丙烯的结构简式:
D.聚丙烯的结构简式:![]()
3.用下列实验装置和方法进行的相应实验,能达到实验目的的是
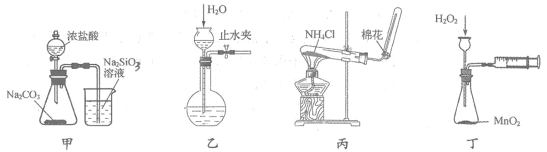 A.用甲装置比较盐酸、碳酸和硅酸的酸性强弱 B.用乙所示方法检验装置的气密性
A.用甲装置比较盐酸、碳酸和硅酸的酸性强弱 B.用乙所示方法检验装置的气密性
C.用丙装置制备和收集氨气 D.用丁装置测定化学反应速率
4.常温下,下列各组离子在指定溶液中一定能大量共存的是
A.饱和氯水中:SO32-、Na+、SO42-、Br-
B.能使甲基橙变红的溶液中:Cu2+、Mg2+、SO42-、Cl-
C.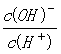 =106的溶液中:NH4+、K+、AlO2-、NO3-
=106的溶液中:NH4+、K+、AlO2-、NO3-
D.1.0mol·L-1的KNO3溶液中:Fe2+、H+、Cl-、I-
5.下列有关物质性质的应用正确的是
A.铁制容器可以盛装冷的浓硫酸,因为常温下铁和浓H2SO4不反应
B.二氧化硅是制造太阳能电池板的主要材料
C.二氧化硫通入酸性KMnO4溶液,溶液紫红色褪去,体现了SO2的漂白性
D.有机磷农药多为磷酸酯或硫代磷酸酯类物质,肥皂水等碱性物质有利其水解而解毒
6.用NA表示阿伏加德罗常数的值。下列说法正确的是
A.常温常压下,2.24L甲烷含有的甲烷分子数目略少于0.1NA
B.12g石墨烯中含有C-C的数目为NA
C.1LpH=13的Ba(OH)2溶液中含有OH-的数目0.2NA
D.一定量的Na2O2与H2O反应产生1.12LO2,则反应中转移电子数为0.1NA
7.四种短周期主族元素W、X、Y、Z的原子序数依次增大,W、X的简单离子具有相同电子层结构,X的原子半径是短周期主族元素原子中最大的,W与Y同族,Z与X形成的离子化合物的水溶液呈中性。下列说法正确的是
A.简单离子半径:W<X<Z
B.W与X可形成两种不同的化合物
C.气态氢化物的热稳定性:W<Y
D.最高价氧化物的水化物的酸性:Y>Z
8.下列物质的转化在给定条件下能实现的是
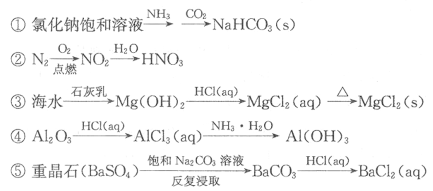
A.①③⑤ B.②③④ C.②④⑤ D.①④⑤
9.下列指定反应的离子方程式正确的是
A.向苯酚钠溶液通入少量的CO2:2C6H5O-+CO2+H2O→2C6H5OH+CO32-
B.向NaNO2溶液中滴加酸性KMnO4溶液:
5NO2-+2MnO4-+3H2O=5NO3-+2Mn2++6OH-
C.向AlC13溶液中滴加过量氨水:A13++3NH3·H2O=Al(OH)3+3NH4+
D.NaHSO4溶液与Ba(OH)2溶液反应至中性:
H++SO42-+Ba2++OH-=BaSO4↓+H2O
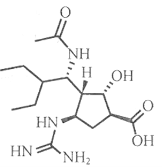 10.我国自主研制的一种可治疗禽流感的新药帕拉米韦,结构如图,下列有关说法正确的是
10.我国自主研制的一种可治疗禽流感的新药帕拉米韦,结构如图,下列有关说法正确的是
A.该有机物的分子式是C15H27O4N4
B.该分子中含有氨基、羧基、羟基、醛基等官能团
C.该分子不仅具有两性,还能发生水解反应和酯化反应
D.该分子中含有5个手性碳原子
11.某工业废水测得其中含有乙酸钠及对氯酚(![]() ),为改善水质现利用微生物电池加以除去,反应原理如下图所示,下列说法正确的是
),为改善水质现利用微生物电池加以除去,反应原理如下图所示,下列说法正确的是
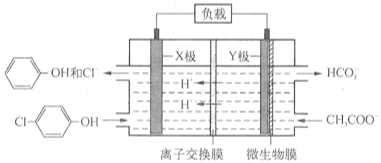
A.X为该生物电池的正极B.该电池能够在高温下工作
C.图中离子交换膜应为阴离子交换膜
D.Y极电极反应方程式为:CH3COO--8e-+4H2O=2HCO3-+9H+
12.下列说法正确的是
A.化学键断裂总是吸收能量,化学键形成总是放出能量,所以放热反应总是自发的
B.在1mL相同浓度的碳酸钠和硫酸钠溶液中,分别滴加2滴0.1mol·L-1AgNO3溶液,只有前者中出现沉淀,说明Ksp(Ag2CO3)<Ksp(Ag2SO4)
C.同温同压下,反应H2(g)+C12(g)=2HCl(g)在光照和点燃条件下的△H相同
D.原电池放电过程中,负极质量一定减轻,正极质量一定增加
13.下列实验对应的现象及结论均正确且两者具有因果关系的是
选项 | 实验 | 现象 | 结论 |
A | 向某未知溶液中加BaC12溶液 | 生成白色沉淀 | 该溶液中一定含有SO42- |
B | 浓硫酸滴入蔗糖中,并搅拌 | 得黑色蓬松的固体并有刺激性气味气体 | 该过程中浓硫酸仅体现吸水性和脱水性 |
C | 向蓝色石蕊试纸上滴加新制氯水 | 试纸边缘呈红色,中间为白色 | 氯水既有酸性又有还原性 |
D | 向盛有KI3溶液的两试管中分别加入淀粉溶液和AgNO3溶液 | 前者溶液变蓝色,后者有黄色沉淀 | KI3溶液中存在 I3- |
14.向20mL0.5mol·L-1的醋酸溶液中逐滴加入等物质的量浓度的烧碱溶液,测定混合溶液的温度变化如图所示。下列关于混合溶液的相关说法中正确的是
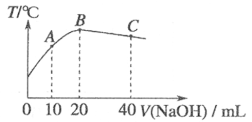 A.醋酸的电离平衡常数:B点<A点
A.醋酸的电离平衡常数:B点<A点
B.由水电离出的c(OH-):B点>C点
C.从A点到B点,混合溶液中不可能存在:
c(CH3COO-)=c(Na+)
D.从B点到C点,混合溶液中一直存在:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
15.700℃时,向容积为1L的密闭容器中充入一定量的CO2和H2,发生反应:
CO2(g)+H2(g)![]() CO(g)+H2O(g)
CO(g)+H2O(g)
反应过程中测定的部分数据见下表(表中t2>t1):
反应时间/min | n(CO2)/mol | n(H2)/mol |
0 | 1.50 | 1.00 |
t1 |
| 0.40 |
t2 | 0.90 |
|
下列说法正确的是
A.反应在t1min内的化学反应速率为v(H2O)=0.60/tlmol·L-1·min-1
B.温度升至800℃,上述反应平衡常数为1.56,则正反应为放热反应
C.保持其他条件不变,向平衡体系中再通入1.00molH2,与原平衡相比,达到新平衡时CO2转化率增大,H2的体积分数增大
D.保持其他条件不变,起始时向容器中充入1.00molCO和1.50molH2O,到达平衡时,c(CO2)=0.90mol·L-1
二、(本题共2小题,共16分)
16.(8分)某有机实验室中,乙酸乙酯的制备的实验步骤如下:
①在100mLA容器中加入22mL(约18g,0.4mol)无水乙醇和12mL(12g,0.2mol)冰醋酸,5mL浓硫酸;混匀后,加入沸石,加装B装置,加热回流0.5h;冷却;
②进行C操作,接受瓶用冷水冷却,加热蒸出生成的乙酸乙酯,直到馏出液体积约为反应物总体积的1/2为止;
③在馏出液中慢慢加入饱和碳酸钠溶液,直到不再有二氧化碳气体产生;用D仪器分出酯层;
④酯层分别用10mL饱和氯化钠溶液、10mL饱和氯化钙溶液、10mL蒸馏水洗一次;酯层用无水硫酸镁干燥;过滤;
⑤进行蒸馏。收集73~78℃的馏分;记录产品外观、产量,计算产率。
(1)上述实验中,A容器的名称是 ,B装置的名称是 ,C操作的名称是 ,D仪器名称是 。
(2)步骤③的主要目的是 。
(3)步骤④中,若不先用饱和氯化钠溶液洗涤,在用氯化钙溶液洗涤时,很有可能产生 ,使进一步分离变得困难;用饱和氯化钠溶液而不是用稀氯化钠溶液是为了 。
17.(8分)
(1)随着原子序数的增加,碱金属Li、Na、K、Rb、Cs下列性质的递变不是单调的是 。
A.熔沸点 B.原子半径 C.晶体密度 D.第一电离能
(2)某离子化合物A2B由四种元素组成,一种为氢,一种为氟,另二种为第二周期元素。正、负离子皆由两种原子构成且均呈正四面体构型。这种化合物的化学式为: 。
(3)好奇心是科学发展的内在动力之一。P2O3和P2O5是两种经典的化合物,其分子结构已经确定。自然而然会有如下问题:是否存在磷氧原子比介于二者之间的化合物?由此出发,化学家合成并证实了这些中间化合物的存在。请写出这些中间化合物的分子式: 。
(4)化学合成的成果常需要一定的时间才得以应用于日常生活。例如,化合物A合成于1929年,至1969年才被用作牙膏的添加剂和补牙填充剂成分。A是离子晶体,由NaF和NaPO3在熔融状态下反应得到。它易溶于水,阴离子水解产生氟离子和对人体无毒的另一种离子。写出合成A的反应方程式: 。
三、(本题共3小题,共22分)
18.(8分)水分子是最简单的分子之一,但其分子间作用力十分复杂,一直是化学领域的研究热点,至今仍有许多问题尚未解决。复杂多样的分子间作用力形成了水的各种不同凝聚形态和奇特的性质。比如:水在低于4℃时热缩冷胀,而大于4℃时,则恢复热胀冷缩。当水结冰的时候,冰的密度小,浮在水面,可以保障水下生物的生存;当天暖的时候,冰在上面,也是最先解冻,这是保障生物存在的很重要的特性。请解答如下问题:
(l)冰是通过水分子间作用力结合而形成的,冰的晶体类型是 。请指出冰中最强的分子间作用力 。
(2)根据水分子之间作用力的不同,冰的结构也多种多样,六方冰是最常见的一种冰,晶胞结构如下图所示。在ac、bc面上有4个水分子,在ab面上没有水分子,一个如下图所示的晶胞包含的水分子个数是 。
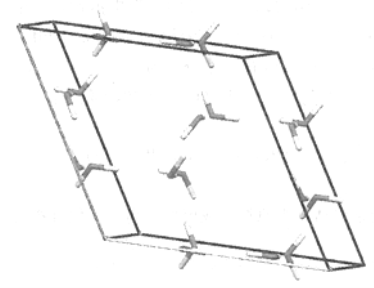
(3)上图所示冰的晶胞参数a=7.82?,c=7.36?,γ=120°,则可算出理论上该晶体的密度为: 。
19.(4分)以Cu为阳极,石墨为阴极,电解含有少量NaOH的15%的NaCl溶液,可得一种半导体产品A,A中金属含量为88.9%。
(1)A的化学式为 。
(2)电解时阴极反应方程式为 。
20.(10分)工业上用铝土矿(主要成分为Al2O3,含有Fe2O3、SiO2等杂质)制取无水氯化铝的一种工艺流程示意如下:
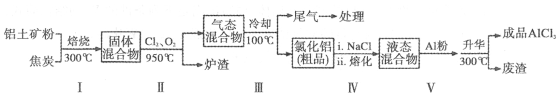 已知:
已知:
物质 | SiCl4 | AlCl3 | FeCl3 | FeCl2 |
沸点/℃ | 57.6 | 180(升华) | 300(升华) | 1023 |
(1)步骤Ⅰ中焙烧使固体水分挥发、气孔数目增多,其作用是(只要求写出一种):
。
(2)步骤Ⅱ中若不通入氯气和氧气,则反应生成相对原子质量比硅大的单质是 。
(3)结合流程及相关数据分析,步骤Ⅴ中加入铝粉的目的是 。
(4)称取含Fe2O3和Al2O3的试样0.2000g,将其溶解在pH=2.0的热溶液中(50℃左右),以磺基水杨酸为指示剂,用0.02000mol·L-1EDTA标准溶液滴定试样中的Fe3+,用去18.00mL。然后将试样调至pH=3.5,加入上述EDTA标准溶液25.00mL,并加热煮沸,使Al3+与EDTA完全反应。再调试液pH=4.5,以PAN[1-(2-吡啶偶氮)-2-苯酚]为指示剂,趁热用CuSO4标准溶液(每毫升含CuSO4·5H2O 0.005000g)返滴定,用去8.00mL。
据此,该试样中Fe2O3的质量分数为,A12O3的质量分数为。
(已知:EDTA与Fe3+、Al3+、Cu2+均按物质的量之比1∶1进行反应。)
四、(本题共1小题,共14分)
21.(14分)下面是以秸秆为原料合成聚酯类高分子化合物的路线:
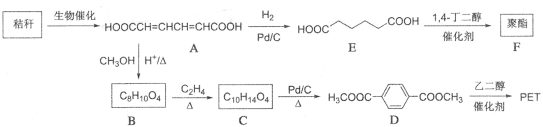
请回答下列问题:
(1)A中官能团的名称为 。
(2)A生成B的反应类型为 。
(3)B的结构简式为 ,C的结构简式为 。
(4)芳香化合物W是D的同分异构体,请写出满足下列条件的W的结构简式:
①0.5molW与足量碳酸氢钠溶液反应生成44g二氧化碳;
②W中有4种不同化学环境的氢原子。
(5)参照上述合成路线,以对二甲苯和乙烯为原料(无机试剂任选),设计制备聚对苯二甲酸乙二醇酯的合成路线。
五、(本题共1小题,共8分)
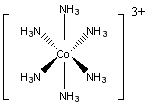
22.(8分)某化合物A含有钴元素,取0.2140gA溶于水,在硝酸存在的条件下用AgNO3溶液滴定,生成白色沉淀,共消耗24.00mL0.100mol·L-1的AgNO3溶液。另取同样质量的A,加入过量NaOH溶液并加热,用50.00mL0.2000mol·L-1HCl溶液吸收逸出的气体,多余的盐酸用NaOH溶液滴定,共消耗26.00mL0.2000mol·L-1NaOH溶液。
(1)试通过计算确定该化合物的化学式。
(2)该化合物中有一个复杂离子,请画出其结构。
“扬子石化杯”
第31届中国化学奥林匹克竞赛(江苏赛区)初赛试卷参考答案
一、选择题(每小题有1~2个选项符合题意,每小题4分,共60分。若有两个正确选项,选错一个得0分,少选一个得2分。)
题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
答案 | BD | C | B | B | D | A | B | D | C |
题号 | 10 | 11 | 12 | 13 | 14 | 15 |
|
|
|
答案 | CD | AD | BC | D | B | AC |
|
|
|
二、(本题共2小题,共16分)
16.(8分)
(1)A 圆底烧瓶 B 回流冷凝管 C 蒸馏 D 分液漏斗(4分,每空1分)
(2)除去酯中混有的醋酸(2分)
(3)絮状的碳酸钙沉淀(1分) 减少洗涤时乙酸乙酯的溶解损耗(1分)
17.(8分)
(1)C(2分)
(2)(NH4)2BeF4(2分)
(3)P4O7、P4O8、P4O9(2分,每个1分,写对2个即得满分)
(4)NaF+NaPO3=Na2PO3F(2分)
三、(本题共3小题,共22分)
18.(8分)
(1)分子晶体 氢键 (4分,每空2分)
(2)12(2分)
(3)0.92g/cm3(2分)
19.(4分)
(1)Cu2O(2分)
(2)2H2O+2e-=H2↑+2OH-(2分)
20.(10分)
(1)防止后续步骤生成的AlCl3水解(或增大反应物的接触面积,加快反应速率)(2分)
(2)Fe或铁(2分)
(3)除去FeCl3,提高AlCl3的纯度(2分)
(4)Fe2O3 14.4%(2分) Al2O3 8.67%(2分)
四、(本题共1小题,共14分)
21.(14分)
(1)羧基 碳碳双键(2分)
(2)取代反应(或酯化反应)(2分)
(3)B:H3COOCCH=CHCH=COOCH3(2分)C:![]() (2分)
(2分)
(4)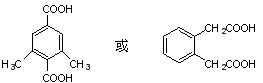 (2分)
(2分)
(5)
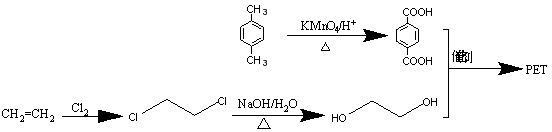
五、(本题共1小题,共8分)
22.(8分)
(1)(6分)
n(NH3)=0.2000×(50.00-26.00)×10-3=4.800×10-3(mol)(1分)
m(NH3)=4.800×10-3×17=8.16×10-2(g)
n(Cl-)=0.1000×24.00×10-3=2.4×10-3(mol)(1分)
m(Cl-)=2.4×10-3×35.5=8.52×10-2(g)
m(Co)=0.2140-8.16×10-2-8.52×10-2=4.72×10-2(g) (1分)
n(Co)=4.72×10-2/59=8.0×10-4(mol)
n(Co)∶n(NH3)∶n(Cl-)=1∶6∶3
该化合物的化学式为Co(NH3)6Cl3(3分)
(2)(2分)
1
版权所有:南京市江宁高级中学 Copyright © 1999-2017 ALL Rights Reserved
信息发布:校务办公室 技术支持:信息中心 储老师