班级 姓名 高一化学必修2![]()
第二章 化学反应与能量
第一节 化学能与热能
课时1 化学键与化学反应中能量变化的关系
【知识清单】
一、化学键与化学反应中能量变化的关系
化学键的 和 是物质在化学反应中发生能量变化的主要原因;物质的化学反应与体系的能量变化是同时发生的,也可以说,一个化学反应既伴随 变化,也伴随 变化。
吸收能量的反应:旧键断裂吸收的能量 新键形成释放的能量
放出能量的反应:旧键断裂吸收的能量 新键形成释放的能量
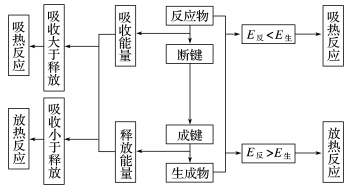
二、化学反应在发生过程中能量变化决定因素
一个确定的化学反应在发生过程中是吸收能量还是放出能量取决于 。一般来说,物质越稳定,含有的总能量 。
吸收能量的反应:反应物的总能量 生成物的总能量,
放出能量的反应:反应物的总能量 生成物的能量。
【知识建构】
我们已经知道,H2在Cl2中燃烧放出大量的能量(当两者混合反应时爆炸),你能根据下列图解解释为什么吗?并根据提供的数据计算生成1mol HCl时放出的能量。
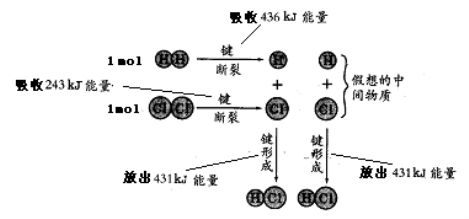
【典型例题】
例题1.已知在一定条件下拆开1molH2中的化学键要吸收436kJ的能量,拆开1molO2中的化学键要吸收496 kJ的能量,形成水分子中的1mol H—O键要放出463 kJ的能量,试计算说明反应2H2+O2=2H2O中的能量变化。(提示:1个H2O分子中含2个H—O键)
例题2.已知反应A+B=C+D放出能量,对该反应的下列说法中正确的是( )
A.A的能量一定高于C
B.A和B的总能量一定高于C和D的总能量
C.B的能量一定高于D
D.该反应放出能量,故不必加热就一定能发生
例题3.氢气和氧气的混合气体遇火即发生爆炸生成水;水在1000℃以上持续加热分解为氢气和氧气;水电解生成氢气和氧气。
(1)H2和O2 化合生成H2O 的反应是 (填“吸收能量”或“放出能量”)反应,H2和O2 的总能量 (填“大于”、“小于”或“等于”)水的总能量,此反应中化学能部分转化为 。
(2)水在高温下分解的反应为 反应,反应中的热能转化为 。
1
第二章 化学反应与能量
班级 姓名 高一化学必修2![]()
【课后习题】
 1.( )下列说法正确的是
1.( )下列说法正确的是
A.任何化学反应都伴随着能量的变化
B.H2O(g)===H2O(l)该过程放出大量的热,所以该过程是化学变化
C..化学反应中能量的变化都表现为热量的变化
![]() D.右图所示的过程是吸收能量的过程
D.右图所示的过程是吸收能量的过程
2.( )已知 2SO2+O2 2SO3 为放出能量的反应,对该反应的下列说法中正确的是
A.O2的能量一定高于SO2的能量
B.SO2和O2的总能量一定高于SO3的总能量
C.SO2的能量一定高于SO3的能量
D.因该反应为放出能量的反应,故不必加热就可发生
3.( )当两个原子形成化学键变成分子时,两个原子的总能量将
A.升高 B.降低 C.保持不变 D.一个升高一个降低
4.( )已知石墨转化为金刚石是吸收能量的反应,由此可知
A.石墨比金刚石更稳定
B.金刚石和石墨可以相互转化
C.金刚石比石墨更稳定
D.金刚石和石墨不能相互转化
5.( )已知反应物的总能量高于产物的总能量,则反应是
A.放出能量的反应 B.吸收能量的反应
C.有催化剂才反应 D.无法判断
6. ( )下列变化过程中需要吸收能量的是
A.H+H→H2 B.H+Cl→HCl
C. I2→I+I D.S+O2→SO2
7. ( )氢气在氯气中燃烧时发出苍白色火焰,在反应过程中,破坏1 mol H2中的化学键消耗的能量为a kJ,破坏1 molCl2中的化学键消耗的能量为b kJ,形成1 mol HCl中的化学键释放的能量为c kJ,下列关系中正确的是( )
A.b>cB.a+b>2cC.a+b<cD.a+b<2c
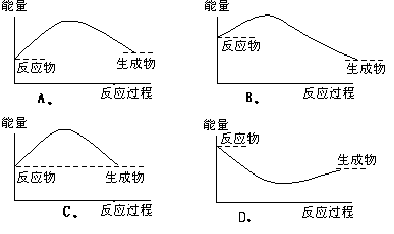
8.( )下列各图中,表示反应是吸收能量的图是
9.已知拆开1 mol H—H键、1 mol N≡N、1 mol N—H键分别需要吸收的能量为436kJ、946kJ、391kJ。则由氢气和氮气反应生成1 mol NH3需要 (填“放出”或“吸收”)
kJ的热量。
1
第二章 化学反应与能量
班级 姓名 高一化学必修2![]()
第二章 化学反应与能量
第一节 化学能与热能
课时2 化学能与热能的相互转化
【知识清单】
【知识建构】
【实验探究2-1】铝与盐酸的反应
盐酸温度 | 反应现象 | 反应后溶液的温度 | 结论 |
|
|
| 1.该反应是 反应; 2. 能转化为 能。 |
【实验探究2-2】氢氧化钡晶体和氯化铵晶体的反应
实验现象 | 结论 |
1.产生 气味气体,混合物呈 状; 2.手触摸杯壁下部感觉 ; 3.玻璃片与烧杯 。 | 1.反应产生 气体,并有 生成; 2.该反应是 反应; 3. 能转化为 能。
|
【实验探究2-3】氢氧化钠与盐酸的反应
盐酸温度 | 氢氧化钠溶液温度 | 反应后温度 | 结论 |
|
|
| 1.该反应是 反应,酸碱中和反应是 反应; 2. 能转化为 能。 |
【典型例题】
例题1.50 mL1.0mol/L盐酸跟50mL1.1mol/L氢氧化钠溶液在下图装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。试回答下列问题。
(1)大小烧杯间填满碎纸条的作用是什么?
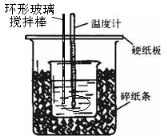 (2)大烧杯上如不盖硬纸板,对求得中和热的数值有何影响?
(2)大烧杯上如不盖硬纸板,对求得中和热的数值有何影响?
(3)改用60 mL1.0mol/L盐酸跟50mL1.1mol/L氢氧化钠溶液进行
反应,与上述实验相比,所放热量是否相等?所求中和热数值是否
相等?简述理由。
例题2. 下列说法正确的是( )
A.汽油车在行驶过程中,热能首先转化为化学能,化学能再转化为动能
B.炸药发生爆炸时,化学能完全转化为热能
C.高温下用炭和铁矿石冶炼金属铁时,热能转化为化学能
D.柴草燃烧时,部分化学能转化为热能
例题3.下列反应中,属于放热反应的是_____,属于吸热反应的是_______(填序号)。
①煅烧石灰石(主要成分是CaCO3)制生石灰(CaO) ②燃烧蜂窝煤取暖
③炸药爆炸 ④硫酸与氢氧化钾溶液反应 ⑤生石灰与水作用制熟石灰
⑥食物腐败 ⑦碳与水蒸气反应制得水煤气
【课后习题】
1.( )下列反应中属于吸热反应的是
A.镁与盐酸反应放出氢气 B.氢氧化钠与盐酸的反应
C.硫在空气或氧气中燃烧 D.Ba(OH)2?8H2O与NH4Cl反应
2.( )下列说法正确的是
A.化学反应除了生成新物质外,还伴随着能量的变化
B.放热反应不需要加热即可发生
C.需要加热条件的化学反应都是吸热反应
D.1mol硫酸与足量氢氧化钠发生反应生成水所释放的热量称为中和热
3.( )下列变化中,吸收热量但不属于吸热反应的是
A.干冰升华 B.生石灰投入水中 C.氢气还原氧化铜 D.酒精挥发
4.( )下列说法不正确的是
A.有能量变化的过程不一定是化学变化
B.化学反应的特征是有新物质生成
C.经过加热而发生的化学反应不一定都是吸热反应
D.只要有化学键的断裂,一定发生化学反应
5.( )航天飞机用的铝粉与高氯酸铵(NH4ClO4)的混合物为固体燃料,点燃时铝粉氧化放热引发高氯酸铵反应,其反应可表示为:2NH4ClO4 ![]() N2↑+ 4H2O+Cl2↑+2O2↑(反应放热),下列叙述中错误的是
N2↑+ 4H2O+Cl2↑+2O2↑(反应放热),下列叙述中错误的是
A.反应属于分解反应
B.上述反应瞬间产生大量高温气体推动航天飞机飞行
C.反应从能量变化上说,主要是化学能转变为热能和动能
D.在反应中高氯酸铵只起氧化剂作用
6.( )下列说法不正确的是
A.物质变化和能量变化是化学反应的两大基本特征
B.物质燃烧和中和反应均放出热量
C.分解反应肯定是吸热反应
D.化学反应是吸热还是放热决定于生成物具有的总能量和反应物具有的总能量
7.煤气的主要成分是CO、H2的混合气体,它由煤炭与水蒸气在高温下反应制得,故又称水煤气。试回答:
(1)写出制取水煤气的主要化学方程式 ,该反应是 反应(填“吸热”或“放热”)。
*(2)设液化石油气的主要成分为丙烷(C3H8),其充分燃烧后产物为CO2和 H2O,试比较完全燃烧等物质的量的C3H8及CO所需氧气的物质的量之比 。
(3)氢气是未来的能源,燃烧时除产生的热量高外,还具有的优点是 ,需要解决的主要问题是 。
8.将V1mL1.0mol·L-1HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如下图所示(实验中始终保持V1+V2=50mL)。请按要求填空:
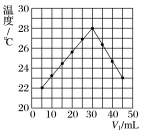
(1)该实验表明此反应________(填“吸收”或“释放”)能量,即:________能可以转化为________能,通过图示分析可以得出:做该实验时,环境温度________(填“高于”、“低于”或“等于”)22℃。
 (2)根据图示计算该NaOH溶液的浓度约是________mol·L-1。
(2)根据图示计算该NaOH溶液的浓度约是________mol·L-1。
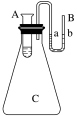
(3)如图所示,在锥形瓶放置有装有水的小试管,往小试管中分别加入下列物质时:①烧碱固体 ②浓硫酸 ③硝酸铵固体 ④NaCl固体,其中能使a端液面高于b端液面的是________。(填序号)
第二章 化学反应与能量
第二节 化学能与电能
课时1 化学能转化为电能
【知识清单】
【知识建构】
1.原电池概念
2.原电池的构成条件
实验步骤 |
|
|
|
|
现象 |
|
|
|
|
解释 或说明 |
|
|
|
|
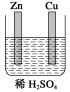
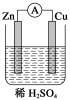
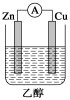
3.原电池的工作原理:(以Zn—Cu/稀硫酸原电池为例)
(1)电极反应:
负极 ;正极
(2)电子流向:
【典型例题】
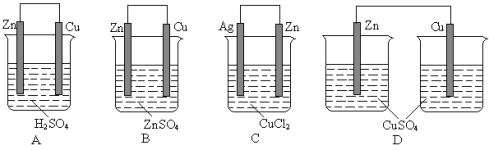
例题1.某原电池的总反应离子方程式为:Zn+Cu2+===Zn2++Cu,则该原电池的正确组成可以是( )
例题2.由铜、锌和稀硫酸组成的原电池中,正极材料是____________________,负极发生的电极反应是______________________,总的电池反应式(离子方程式)是______________________________。当导线中有1mol电子通过时,理论上两极的变化是_____________________(填序号)。
① 锌片溶解了32.5g
② 锌片增重32.5g
③ 铜片上析出1g H2
④ 铜片上析出1mol H2
*例题3.根据构成原电池的条件及原电池原理,给你以下物质或用品,你能设计出多少组原电池,画出你的装置简图。
用品:镁条、铜片、铁片、导线、金属夹、手电筒用小灯泡(或发光二极管)、橙汁、柠檬汁、500mL烧杯。
【课后习题】
1.( )下列说法中正确的是
A.原电池是把电能转化为化学能的装置
B.原电池中的阳离子向正极移动
C.原电池两级均发生氧化还原反应
D.原电池中电子流出的一极是正极,发生氧化反应
2.( )在下图的装置中,属于原电池且有持续电流产生的是
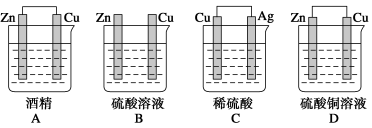
3.( )某金属能和盐酸反应生成氢气,该金属与锌组成原电池时,锌为负极,则该金属可能为
A.铝 B.铜 C.硅 D.锡
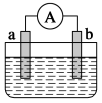 4.( )如图所示,两电极一为碳棒,一为铁片,若电流表的指针发生偏转,且a极上有大量气泡生成,则以下叙述正确的是
4.( )如图所示,两电极一为碳棒,一为铁片,若电流表的指针发生偏转,且a极上有大量气泡生成,则以下叙述正确的是
A.a为负极,是铁片,烧杯中的溶液为硫酸
B.b为负极,是铁片,烧杯中的溶液为硫酸铜溶液
C.a为正极,是碳棒,烧杯中的溶液为硫酸
D.b为正极,是碳棒,烧杯中的溶液为硫酸铜溶液
5.( )X、Y、Z都是金属,把X浸入Z的硝酸盐溶液中,X的表面有Z析出,X和Y组成原电池时,Y为电池的负极。X、Y、Z三种金属的活动性顺序为
A.X>Y>Z B.X>Z>Y C.Y>Z>X D.Y>X>Z
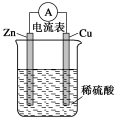 6.( )右图为铜锌原电池示意图,下列说法正确的是
6.( )右图为铜锌原电池示意图,下列说法正确的是
A.锌片逐渐溶解
B.烧杯中溶液逐渐呈蓝色
C.电子由铜片通过导线流向锌片
D.Zn为正极,Cu为负极
7.由铜片、锌片和100mL硫酸铜溶液组成的原电池工作一段时间后,铜片质量增加了12.8g,且溶液恰好变为无色。假设锌片上没有铜析出,试计算:
(1)锌片质量减轻了多少_______________________克。
(2)共有_______________________个电子流过外电路。
(3)原硫酸铜溶液的物质的量浓度为_______________。
8.按图所示,组装一种原电池装置。试回答下列问题(灯泡功率合适):
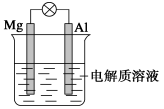 ⑴ 电解质溶液为稀硫酸时,灯泡_____ (填“亮”或“不亮”,填“亮”做a题,填“不亮”做b题)。
⑴ 电解质溶液为稀硫酸时,灯泡_____ (填“亮”或“不亮”,填“亮”做a题,填“不亮”做b题)。
a.若灯泡亮,则Mg电极上发生的电极反应式为 ________________________,Al电极上发生的电极反应式为_____________________________;
b.若灯泡不亮,其理由为_________________________。
*⑵ 电解质溶液为NaOH(aq)时,灯泡______ (填“亮”或“不亮”,填“亮”做a题,填“不亮”做b题)。
a.若灯泡亮,则Mg电极上发生______(填“氧化”或“还原”)反应,Al电极作_____极;
b.若灯泡不亮,其理由为______________________________________________。
9.现有如下两个反应:
① NaOH+HCl===NaCl+H2O
② Cu+2Ag+===2Ag+Cu2+
⑴ 根据两反应本质,判断能否设计成原电池_________________________________。
⑵ 如果不能,说明其原因__________________________________________________
________________________________________________________________________。
⑶ 如果可以,则写出正、负极材料、其电极反应式、反应类型(“氧化”或“还原”):
负极:________,____________________,________反应。
正极:________,____________________,________反应。
若导线上转移电子1mol,则正极质量增加________g。
第二章 化学反应与能量
第二节 化学能与电能
课时2 发展中的化学电源
【知识清单】
化学电源又称电池,是一种能将化学能直接转变成电能的装置,它通过化学反应,消耗某种化学物质,输出电能。常见的电池大多是化学电源。它在国民经济、科学技术、军事和日常生活方面均获得广泛应用。
干电池也称一次电池,即电池中的反应物质在进行一次电化学反应放电之后就不能再次使用了。常用的有锌锰干电池、锌汞电池、镁锰干电池等。
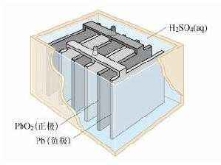
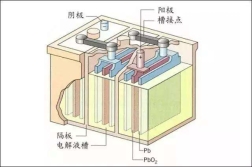
蓄电池是可以反复使用、放电后可以充电使活性物质复原、以便再重新放电的电池,也称二次电池。其广泛用于汽车、发电站、火箭等部门。由所用电解质的酸碱性质不同分为酸性蓄电池和碱性蓄电池。
燃料电池与前两类电池的主要差别在于:它不是把还原剂、氧化剂物质全部贮藏在电池内,而是在工作时不断从外界输入氧化剂和还原剂,同时将电极反应产物不断排出电池。燃料电池是直接将燃烧反应的化学能转化为电能的装置,能量转化率高,可达80%以上,而一般火电站热机效率仅在30%~40%之间。燃料电池具有节约燃料、污染小的特点。
【知识建构】
1.干电池
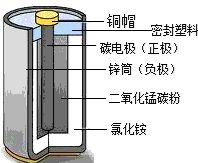
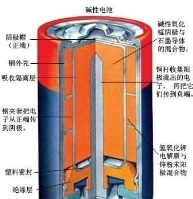
负极反应:
2.充电电池
![]() 铅蓄电池充、放电的总方程式为: Pb+PbO2+2H2SO4 2PbSO4+2H2O
铅蓄电池充、放电的总方程式为: Pb+PbO2+2H2SO4 2PbSO4+2H2O
放电过程将 能转化为 能;
充电过程将 能转化为 能。
3.燃料电池
![]() 负极:
负极:
(1)酸性介质 总反应式:
正极:
![]() 负极
负极
*(2)碱性介质 总反应式:
正极
【典型例题】
例题1.日常所用干电池其电极分别为碳棒(上面有铜帽)和锌皮,以糊状NH4Cl和ZnCl2作电解质(加入MnO2吸收H2),电极反应可简化为:Zn-2e-=Zn2+, 2NH4++2e-=2NH3+H2。
(1)判断该电池的正负极,并指明反应类型。
(2)该电池工作效率不如碱性锌锰电池高,简析其中的原因。
例题2.铅蓄电池可放电亦可充电,它是用硬橡胶和透明塑料制成长方形外壳,在正极板上有一层棕褐色的PbO2,负极是海棉状的金属铅,两极均浸入硫酸溶液中,且两极间用橡胶或微孔塑料隔开。放电时起原电池的作用。
![]() 负极:Pb-2e-+SO42-=PbSO4正极:PbO2+2e-+4H++SO42-=PbSO4+2H2O
负极:Pb-2e-+SO42-=PbSO4正极:PbO2+2e-+4H++SO42-=PbSO4+2H2O
铅蓄电池充电和放电的总化学方程式为: Pb+PbO2+2H2SO4 2PbSO4+2H2O
(1)下列有关说法正确的是( )
A.电池放电时,PbO2被氧化
B.电池放电时,电解质溶液的酸性增强
C.上述充电和放电时的反应为可逆反应
D.铅蓄电池报废后应回收,以防铅和酸污染
(2)计算向外电路提供10mol电子时,消耗硫酸的物质的量。
例题3.氢氧燃料电池已用于航天飞机。以30%KOH溶液为电解质溶液的这种电池在使用时的电极反应如下:负极:2H2 + 4OH--4e-= 2H2O 正极:O2 + 2H2O + 4e- = 4OH-
据此作出判断,下列说法中错误的是( )
A.H2在负极发生氧化反应
B.供电时的总反应为:2H2 + O2 == 2H2O
C.产物为无污染的水,属于环境友好电池
D.燃料电池的能量转化率为100%
【课后习题】
1.( )废电池的污染引起人们的广泛重视,废电池中对环境形成污染的主要物质是
A.锌 B.二氧化锰 C.石墨 D.汞
2.( )一个原电池的总反应的离子方程式是Zn+Cu2+===Zn2++Cu,该原电池的合理组成是
| 正极 | 负极 | 电解质溶液 |
A | Zn | Cu | CuCl2 |
B | Cu | Zn | H2SO4 |
C | Cu | Zn | CuSO4 |
D | Zn | Fe | CuCl2 |
3.( )汽车的启动电源常用铅蓄电池,其放电时的原电池反应如下:PbO2+Pb+2H2SO4===2PbSO4+2H2O,根据此反应判断,下列叙述中正确的是
A.Pb是正极
B.PbO2得电子,被氧化
C.负极反应是Pb+SO-2e-===PbSO4
D.电池放电时,溶液的酸性增强
4.( )已知空气一锌电池的电极反应为:
![]() 锌片Zn+2OH--2e-= ZnO+H2O,石墨 O2+H2O+2e-=2OH-。
锌片Zn+2OH--2e-= ZnO+H2O,石墨 O2+H2O+2e-=2OH-。
据此判断锌片是
A.负极,并被氧化 B.负极,并被还原
C.正极,并被氧化 D.正极,并被还原
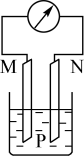 5.( )右下图所示装置中,观察到电流计的指针偏转,M棒变粗,N棒变细,由此判断下表中所列M、N、P物质,其中可以成立的是
5.( )右下图所示装置中,观察到电流计的指针偏转,M棒变粗,N棒变细,由此判断下表中所列M、N、P物质,其中可以成立的是
| M | N | P |
A | 锌 | 铜 | 稀硫酸 |
B | 铜 | 铁 | 稀盐酸 |
C | 银 | 锌 | 硝酸银溶液 |
D | 锌 | 铁 | 硝酸铁溶液 |
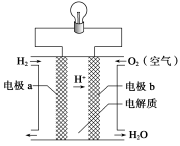 6.( )氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如下图所示。下列有关氢氧燃料电池的说法,正确的是
6.( )氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如下图所示。下列有关氢氧燃料电池的说法,正确的是
A.该电池工作时电能转化为化学能
B.该电池中电极a是正极
C.外电路中电子由电极b通过导线流向电极a
D.该电池的总反应:2H2+O2===2H2O
7.1kg锂燃烧可放出42998 kJ的热量,如将1 kg锂通过热核反应放出的能量相当于20000t优质煤的燃烧。
⑴ 写出锂燃烧的化学方程式_____ _。
*⑵ Li还可以组成Li电池,它是一种高能电池,在电池中Li作_ _极,Li是IA族元素,在该电池中的电解质采用非水溶性有机电解质,原因是 __。Li-I2电池常作心脏起搏器的电源,若电池中Li为14g,则理论上需I2为_ _g,可产生 _C电量(1个电子的电量为1.6×10-19C,锂的相对原子质量取7.0,碘的相对原子质量取127)。
第二章 化学反应与能量
第三节 化学反应的速率和限度
课时1 化学反应的速率
【知识清单】

【知识建构】
1.化学反应速率: 物理量。
2.表示方法:通常用 (均取正值)来表示。
3.计算:表达式为v=
式中:Δc为 ,一般以 为单位;Δt为时间,一般以 为单位。故化学反应速率的常用单位 。
4.注意点
⑴ Δt表示某一时间段,故化学反应速率是 速率,而非瞬时速率。
⑵ 表示化学反应速率时,必须指明具体的物质,因为同一化学反应,用不同的物质表示反应速率,其数值可能不同。
⑶ 对于有固体或纯液体参加的反应,由于固体或纯液体的浓度为一常数,即Δc=0(无意义),所以不用固体或纯液体表示反应速率。
⑷ 对于一个具体的化学反应,反应物和生成物的物质的量的变化是按化学方程式中化学计量数之比进行的,所以化学反应中各物质的反应速率之比等于化学方程式中各物质的化学计量数之比。
⑸ 在同一时间内的同一个化学反应里,虽然用不同物质表示的化学反应速率不一定相同,但它们表示的意义相同,即一种物质的化学反应速率就代表了整个化学反应的反应速率。
5.影响化学反应速率的因素
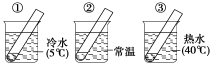
【实验探究2-5】1.温度对化学反应速率影响的探究
实验 操作 |
试管中均为2~3mL相同浓度的滴有FeCl3溶液的H2O2溶液 | ||
实验 现象 | ①产生气泡速率最 | ②产生气泡速率较 | ③产生气泡速率最 |
实验 结论 | 对于反应2H2O22H2O+O2↑来说,温度越高,H2O2的分解速率越 ,反应越 | ||
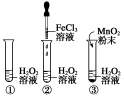
【实验探究2-6】2.催化剂对化学反应速率影响的探究
实验操作 |
| ||
实验现象 | ①有 量气泡出现 | ②产生 量气泡 | ③产生 量气泡 |
实验结论 | MnO2、FeCl3可以使H2O2分解的速率 | ||
影响化学反应速率的因素除 和 外,还有 、反应物的 、固体表面积、压强、溶剂、光照等许多因素。人们可以通过这些因素来调控化学反应速率。
【典型例题】
例题1.在2L的密闭容器中发生反应 N2(g)+ 3H2(g) ![]() 2NH3(g),在5min内NH3的物质的量增加了0.1mol,求v(NH3)、v(N2)、v(H2)。
2NH3(g),在5min内NH3的物质的量增加了0.1mol,求v(NH3)、v(N2)、v(H2)。
例题2.下列各组反应(表中物质均为反应物)中,反应初始产生H2速率最快的是( )
编号 | 金属(粉末状)/mol | 酸的浓度及体积 | 反应温度/℃ |
A | Mg,0.1 | 3mol·L-1硫酸10mL | 60 |
B | Mg,0.1 | 3mol·L-1盐酸10mL | 60 |
C | Fe,0.1 | 3mol·L-1盐酸10mL | 60 |
D | Mg,0.1 | 3mol·L-1硫酸10mL | 50 |
例题3.结合影响化学反应速率的因素思考下列问题。
(1)人们为什么用电冰箱储藏食物?
(2)实验室通常要将两种块状或颗粒状的固体药品研细,并混合后再进行反应。原因是什么?
(3)实验室进行化学反应时,通常把要一些固体物质溶于水配成溶液再进行反应。原因是什么?
(4)稀硫酸和锌粒的反应,反应一段时间后气体会减少(锌粒有剩余)。当我们重新加入稀硫酸时又会产生较多量的气体,为什么?
(5)为什么用棕色试剂瓶保存见光易分解的物质?
【课后习题】
1.( )加快反应速率可以采取的方法是
A.升高温度 B.减小压强
C.降低温度 D.减小反应物浓度
2.( )下列关于化学反应速率的说法中,不正确的是
A.化学反应速率是衡量化学反应进行快慢程度的物理量
B.化学反应速率通常用单位时间内生成或消耗某物质的质量的多少来表示
C.在同一个反应中,各物质的反应速率之比等于化学方程式中的计量数之比
D.化学反应速率的常用单位有mol/(L·s)和mol/(L·min)
3.( )反应4NH3(g) + 5O2(g)= 4NO(g) +6H2O(g)在5L的密闭容器中进行,1分钟后,NO的物质的量增加了0.6mol,则此反应的平均速率v(表示反应物的消耗速率或生成物的生成速率)为
A.v(NH3)= 0.002 mol/(L·s) B.v(O2)= 0.01 mol/(L·s)
C.v(NO )= 0.008mol/(L·s) D.v(H2O)= 0.006 mol/(L·s)
4.( )下列措施对增大反应速率明显有效的是
A.Al在氧气中燃烧生成A12O3,将Al片改成Al粉
B.Fe与稀硫酸反应制取H2时,改用浓硫酸
C.在K2SO4与BaCl2两溶液反应时,增大压强
D.Na与水反应时增大水的用量
5.( )反应4A(s)+3B(g)===2C(g)+D(g),经2min,B的浓度减少0.6mol·L-1。下列叙述正确的是
A.用A表示的反应速率是0.4mol·L-1·min-1
B.分别用B、C、D表示反应的速率,其比值是3∶2∶1
C.在2min末的反应速率,用B表示是0.3mol·L-1·min-1
D.在这2min内B和C两物质浓度都是逐渐减小的
6.反应A+3B==2C+2D在四种不同情况下的反应速率分别为:
① v(A)=0.15 mol·L-1·s-1;② v(B)=0.6mol·L-1·s-1;
③ v(C)=0.4 mol·L-1·s-1;④ v(D)=0.45 mol·L-1·s-1。
该反应进行的快慢顺序为 。
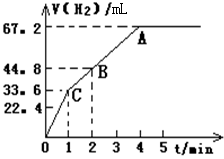 7.把一定量(足量)的Zn粉加入50 mL一定浓度的盐酸中,在标准状况下放出气体的体积和反应时间的关系如图所示。回答下列问题:
7.把一定量(足量)的Zn粉加入50 mL一定浓度的盐酸中,在标准状况下放出气体的体积和反应时间的关系如图所示。回答下列问题:
(1)实验时放出气体的总体积为 。
(2)放出一半气体所需的时间为 。
(3) 设OC段的平均反应速率为v 1,CB段的平均反应速率为v 2,则v 1 v 2(填“>”、“<”或“=”)。
设OC段的平均反应速率为v 1,CB段的平均反应速率为v 2,则v 1 v 2(填“>”、“<”或“=”)。
(4)所用盐酸的物质的量浓度为 。
第二章 化学反应与能量
第三节 化学反应的速率和限度
课时2 化学反应的限度
【知识清单】
1. 化学平衡状态
如果外界条件(温度、浓度、压强等)不发生改变,当可逆反应进行到一定程度时,正反应速率与逆反应速率相等,反应物的浓度与生成物的浓度不再改变,达到一种表面静止的状态,称为“化学平衡状态”,简称化学平衡。
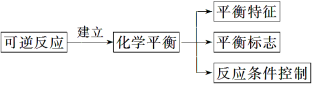
2. 化学平衡状态的特征

【知识建构】
1.可逆反应
(1)定义:在 条件下,正反应方向和逆反应方向均能 进行的化学反应称为可逆反应。
(2)特征
①可逆反应在一定条件下不能进行到底,只能进行到一定程度,反应有一定限度。
②在可逆反应的化学方程式中,用“![]() ”号代替“===”号。
”号代替“===”号。
(3)常见的可逆反应
2.化学平衡的建立
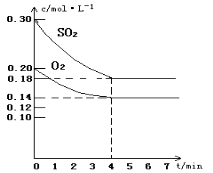
对于可逆反应2SO2+O2![]() 2SO3,在一定温度下,将2molSO2(g)和1molO2(g)通入一定体积的密闭容器中。其化学反应速率与时间关系如图所示。分析回答下列问题:
2SO3,在一定温度下,将2molSO2(g)和1molO2(g)通入一定体积的密闭容器中。其化学反应速率与时间关系如图所示。分析回答下列问题:
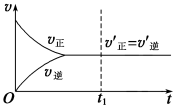
①反应开始时,正反应速率最大,原因是 ;逆反应速率为0,原因是 ;
②反应进行中,正反应速率的变化是逐渐 ,原因是 ;逆反应速率的变化是逐渐 ,原因是 。
③反应一段时间(t1)后,正反应速率和逆反应速率的关系是 ,反应物的浓度 ,生成物的浓度 。
3. 化学平衡状态的特征
以mA(g)+nB(g)![]() pC(g)+qD(g)为例说明可逆反应达到平衡状态的判断方法。
pC(g)+qD(g)为例说明可逆反应达到平衡状态的判断方法。
1. 直接判断:
2. 间接判断:
【典型例题】
例题1.下列反应体系中,不属于可逆反应的是( )
A.N2和H2合成氨
B.SO2与O2化合成SO3
C.水电解生成H2和O2与H2在O2中燃烧生成水
D.密闭容器内NO2和N2O4可以相互转化
例题2.可逆反应N2(g)+3H2(g)![]() 2NH3(g)的正、逆反应速率可用各反应物或生成物浓度的变化来表示。下列各关系中能说明反应已达到平衡状态的是( )
2NH3(g)的正、逆反应速率可用各反应物或生成物浓度的变化来表示。下列各关系中能说明反应已达到平衡状态的是( )
A. 3v正(N2)=v正(H2)
B. v正(N2)=v逆(NH3)
C. 2v正(H2)=3v逆(NH3)
D. v正(N2)=3v逆(H2)
例题3.可逆反应2NO2(g)![]() 2NO(g)+O2(g)在恒定容积密闭容器中反应,达到平衡状态的标志是( )
2NO(g)+O2(g)在恒定容积密闭容器中反应,达到平衡状态的标志是( )
A.单位时间内生成n molO2的同时生成2n molNO2
B.反应容器内,物质的分子总数不随时间的变化而变化
C.用NO2.、 NO、O2的物质的量浓度变化表示的反应速率的比为2 :2:1
D.混合气体的颜色不再改变的状态
【课后习题】
1.( )在溶液中发生的反应,对反应速率不产生影响的因素是
A.温度 B.压强 C.浓度 D.催化剂
2.( )在反应:C(s)+CO2(g)![]() 2CO(g)中,可使反应速率增大的措施是
2CO(g)中,可使反应速率增大的措施是
①增大压强 ②升高温度 ③通入CO2 ④增加碳的量 ⑤降低压强
A.①②③④ B.②③④⑤ C.①②③ D.②③④
3.( )化学反应限度的调控在工来生产上和环保技术等方面得到了广泛的应用。若设法提高化学反应的限度,则下列说法中错误的是
A. 一定能够提高化学反应速率
B.能够提高原料的利用率
C.能够提高经济效益
D.能够节约原料和能量
*4.( )下列说法可以说明密闭容器中的反应:P(g)+Q(g) ![]() R(g)+S(g)在恒温下已达平衡状态的是
R(g)+S(g)在恒温下已达平衡状态的是
A.反应容器内压强不随时间变化而变化
B.P和S的生成速率相等
C.反应容器内P、Q、R、S四者共存
D.反应容器内总物质的量不随时间变化而变化
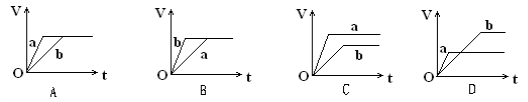
5.( )向等质量的a、b两份锌粉中,分别加入过量的稀H2SO4,同时向a中加入少量的CuSO4溶液。下图表示产生H2的体积(V)与时间(t)的关系,其中正确的是
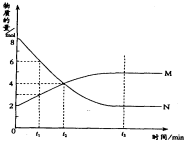 6.( )在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是
6.( )在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是
A.反应的化学方程式为:2 M(g)![]() N(g)
N(g)
B.t2时,正逆反应速率相等,达到平衡状态
C.t1时,N的浓度是M浓度的2倍
D.t3时,正反应速率大于逆反应速率
7.( )1 mol N2和3 mol H2合成NH3达到平衡时,下列说法中正确的是
A.NH3的生成速率与分解速率相等
B.N2、H2、NH3的分子数相等
C.n(N2)∶n(H2)∶n(NH3)=1∶3∶2
D.c(N2)=c(H2)=c(NH3),且保持不变
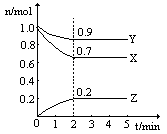 8.某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。回答下列问题:
8.某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。回答下列问题:
(1)该反应的化学方程式为 ;
(2)从开始至2min,Z的平均反应速率为 ;
*(3)若X、Y、Z均为气体,反应达平衡时,此时体系的压强是开始时的 倍。
第二章 化学反应与能量
复习课
【知识清单】
【知识建构】
1.化学反应中的能量变化
2.对比铜锌原电池与直流电源或干电池的实验,得出有关的电极名称、电流流动方向、电子流动方向等。
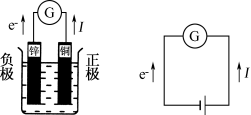
电极反应(电解质为H2SO4):
负极(锌片)______________________(__________________反应)
正极(铜片)______________________(__________________反应)
3.以可逆反应氮气与氢气合成氨为例,回答下列问题:
(1)当反应刚开始时,是正反应速率大还是逆反应速率大?
(2)随着反应的进行,反应物浓度和生成物浓度如何变化?
(3)随着反应的进行,正反应速率和逆反应速率如何变化?
(4)做出某反应建立平衡过程中速率时间图像。
(5)如何判断一个可逆反应是否达到化学平衡状态?
【典型例题】
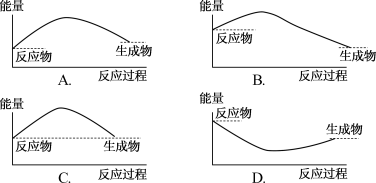
例题1.下列各图中,表示正反应是吸热反应的是( )
例题2.由铜、锌和稀硫酸组成的原电池中,正极材料是____________________,负极发生的电极反应是______________________,总的电池反应式(离子方程式)是______________________________。当导线中有1mol电子通过时,理论上两极的变化是_____________________(填序号)。
① 锌片溶解了32.5g② 锌片增重32.5g
③ 铜片上析出1g H2④ 铜片上析出1mol H2
例题3.下列说法中不正确的是( )
A.当一个可逆反应达到平衡状态时,就是这个反应在该条件下所能达到的限度
B.当一个可逆反应达到平衡状态时,这个反应的正反应速率和逆反应速率相等
C.可以通过控制反应条件,使2molSO2与1molO2反应生成2molSO3
D.化学反应的限度可以通过改变条件来改变
【课后习题】
1.( )已知反应X+Y===M+N为放热反应,下列有关说法正确的是
A.X的能量一定高于M
B.Y的能量一定高于N
C.X和Y的总能量一定高于M和N的总能量
D.因该反应为放热反应,所以一定不必加热就可以发生
2.( )下列有关能量转换的说法不正确的是
A. 煤燃烧是化学能转化为热能的过程
B.化石燃料和植物燃料燃烧时放出的能量均来源于太阳能
C. 动物体内葡萄糖被氧化成CO2是热能转变成化学能的过程
D. 植物通过光合作用将CO2转化为葡萄糖是太阳能转变成化学能的过程
3.( )用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率加快的是
A.加热 B.不用稀硫酸,改用98%的浓硫酸
C.滴加少量CuSO4溶液 D.不用铁片,改用铁粉
4.( )2SO2(g)+O2(g)![]() 2SO3(g)是制备硫酸的重要反应。下列叙述正确的是
2SO3(g)是制备硫酸的重要反应。下列叙述正确的是
A.催化剂V2O5不改变该反应的逆反应速率
B.增大反应体系的压强,反应速度一定增大
C.该反应是放热反应,降低温度将缩短反应达到平衡的时间
![]() D.在t1、t2时刻,SO3(g)的浓度分别是c1,c2,则t1~t2内,SO3(g)生成的平均速率
D.在t1、t2时刻,SO3(g)的浓度分别是c1,c2,则t1~t2内,SO3(g)生成的平均速率
为ν=
5.将ag块状碳酸钙跟足量的盐酸反应,反应物损失的质量随时间的变化曲线如图中的实线所示,在相同条件下,将bg(a>b)粉末状碳酸钙与同浓度的盐酸反应,则相应的曲线如图中的虚线所示。其中正确的是
![]()
![]()



![]()

![]()
0 t 0 t 0 t O t
A B C D
6.对于反应2SO2+O2![]() 2SO3(g),当其他条件不变时,只改变一个反应条件,将生成的SO3的反应速率的变化填入下表空格内(填“增大”、“减小”或“不变”)。
2SO3(g),当其他条件不变时,只改变一个反应条件,将生成的SO3的反应速率的变化填入下表空格内(填“增大”、“减小”或“不变”)。
编号 | 改变的条件 | 生成SO3的速率 |
① | 升高温度 |
|
② | 降低温度 |
|
③ | 增大氧气的浓度 |
|
④ | 使用催化剂 |
|
7.氢能源是21世纪极具发展前景的新能源之一,它既是绿色能源,又可循环使用。
(1)请在下图的两个空格中填上循环过程中反应物和生成物的分子式,以完成理想的氢能源循环体系图(循环中接受太阳能的物质在自然界中广泛存在)。
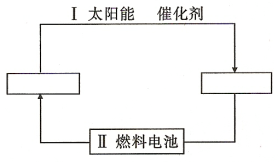
(2)从能量转换的角度看,过程Ⅱ应是_________能转化为_________能。
*(3)该燃料电池中以KOH溶液作电解质溶液,写出该电池负极反应式:
____________________________________________。
*8.在 2 L的密闭容器中, 充入 1 mol N2 和 3 mol H2, 在一定的条件下反应, 2 分钟后达到平衡状态, 相同温度下, 测得平衡时混合气体的压强比反应前混合气体的压强减小了 1/10, 填写下列空白:
(1)平衡时混合气体中三种气体的物质的量比为 _________________;
(2)N2 的转化率为 _______________;
(3)2分钟内,NH3 的平均反应速率为 _______________。
1
第二章 化学反应与能量





 高一化学必修2学案-第四章
高一化学必修2学案-第四章
 苏公网安备32011502010134号
苏公网安备32011502010134号